题目内容
14.已知NaNO2 能发生如下反应:NaNO2+HI→NO+I2+NaI+H2O (未配平)
(1)该反应的还原剂是HI,发生还原反应的物质是NaNO2.
(2)从上述反应推知C.
A.氧化性:I2>NaNO2B.氧化性:NaNO2>HI
C.还原性:HI>NOD.还原性:I2>HI
(3)当有0.75mol HI被氧化时,在标准状况下产生气体的体积是16.8L.
分析 反应中N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,结合氧化剂氧化性大于氧化产物的氧化性,还原剂还原性大于还原产物达到还原性解答该题.
解答 解:(1)反应中N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,则HI为还原剂,NaNO2为氧化剂,被还原,
故答案为:HI;NaNO2;
(2)氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,还原剂还原性大于还原产物达到还原性,则还原性:HI>NO,氧化性:NaNO2>I2,故答案为:C;
(3)反应的方程式为2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,当有0.75mol HI被氧化时,转移0.75mol电子,则生成n(NO)=$\frac{0.75mol}{3-2}$=0.75mol,在标准状况下产生气体的体积是0.75mol×22.4L/mol=16.8L,
故答案为:16.8.
点评 本题考查氧化还原反应及有关计算,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
18.对于玻璃器皿上黏有的一些水洗不掉的残留物,下列洗涤方法正确的是( )
①残留在试管内壁上的碘,用酒精洗涤
②试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤.
①残留在试管内壁上的碘,用酒精洗涤
②试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
2.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛监的叙述中错误的是( )


| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它能发生氧化反应 | ||
| C. | 它是不饱和的有机物 | D. | 该物质是高分子化合物 |
19.下列说法正确的是( )
| A. | 高分子化合物是纯净物 | |
| B. | 石油的裂化和煤的干馏属于化学变化,煤的液化属于物理变化 | |
| C. | 糖一定有甜味,有甜味的可能是糖 | |
| D. | 钠可以保存在十二烷中 |
6.如图所示的装置中,有关说法不正确的是( )
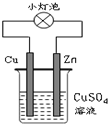

| A. | 该装置实现化学能转变为电能 | |
| B. | 该装置中Cu2+向Cu电极移动 | |
| C. | 该装置中Cu棒上Cu2+发生氧化反应析出Cu | |
| D. | 该装置中Zn棒上的电极反应为:Zn-2e-═Zn2+ |
 .
.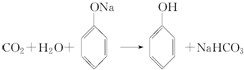
 +H2O.
+H2O.