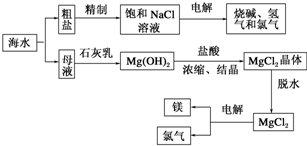
题目内容
14.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程.其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应.其过程可以用如下化学方程式表示:①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑;
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH (未配平);
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH;
下列说法不正确的是( )
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.反应③中没有元素的化合价变化;
C.反应②中Fe元素的化合价由+2价升高为+3价,N元素的化合价由+3价降低为-3价,根据电子守恒和原子守恒配平方程式;
D.Fe元素由0升高为+2、+3,n(Fe)=$\frac{16.8g}{56g/mol}$=0.3mol.
解答 解:A.氧化剂的氧化性大于氧化产物的氧化性,由①可知NaNO2的氧化性比Na2FeO2的强,由②可知NaNO2的氧化性比Na2Fe2O4的强,故A正确;
B.反应③中没有元素的化合价变化,不属于氧化还原反应,故B错误;
C.反应②中Fe元素的化合价由+2价升高为+3价,N元素的化合价由+3价降低为-3价,则配平方程式为:6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数是5,故C正确;
D.Fe元素由0升高为+2、+3,n(Fe)=$\frac{16.8g}{56g/mol}$=0.3mol,由三个反应可知则转移的电子为0.1mol×(2-0)+0.2mol×(3-0)=0.8mol,故D正确;
故选B.
点评 本题考查氧化还原反应,明确三个反应中元素的化合价变化是解答本题的关键,选项D为学生解答的易错点和难度,注意四氧化三铁中Fe元素的化合价,题目难度中等.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
4.若下列物质均为1mol,则含原子数最多的是( )
| A. | CO | B. | CH4 | C. | N2 | D. | NO |
5.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是碳(填元素名称).
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为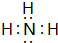 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.
(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
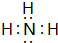 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
2.下列每组均有三种等物质的量浓度、等体积的溶液,若将它们混合起来,无沉淀物产生的是( )
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
6.下列离子水解的离子方程式中正确的是( )
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
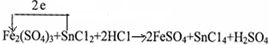 .
.