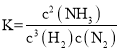题目内容
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:![]() ,达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
,达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
A.x=1
B.B的转化率为20%
C.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
D.平衡时A的浓度为0.75mol/L
【答案】BD
【解析】
达到平衡时,生成了2molC,经测定,D的浓度为0.5mol·L1,生成D为0.5mol/L×4L=2mol,生成C、D的物质的量相同,结合反应可知x=2,则
3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
开始(mol)6500
转化(mol)3122
平衡(mol)3422
A、由上述分析可知,x=2,故A错误;
B、B的转化率为![]() ×100%=20%,故B正确;
×100%=20%,故B正确;
C、达到平衡时,在相同温度下容器内混合气体的压强是反应前的![]() =1倍,即压强不变,故C错误;
=1倍,即压强不变,故C错误;
D、平衡时,A的浓度为![]() =0.75mol·L1,故D正确。
=0.75mol·L1,故D正确。

【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
| 滴管 | 试管 | |
0.2molL-1 CuSO4溶液 | 0.2molL-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
0.2molL-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
0.2molL-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
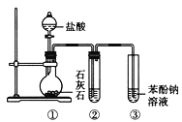
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3yCu(OH)2zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。