��Ŀ����
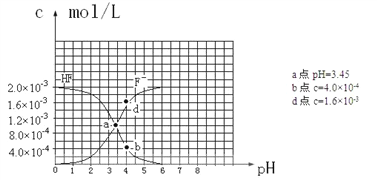
����Ŀ���Ҵ�����Ҫ���л�����ԭ�ϣ�������ϩˮ�Ϸ���������Ӧ�Ļ�ѧ����ʽ���£�C2H4(g) + H2O(g) ![]() C2H5OH(g) ����ͼΪ��ϩ��ƽ��ת�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ[��ʼn(C2H4) : n(H2O) =1:1]��
C2H5OH(g) ����ͼΪ��ϩ��ƽ��ת�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ[��ʼn(C2H4) : n(H2O) =1:1]��

�����й�������ȷ����
A. Y��Ӧ���Ҵ������ʵ�������Ϊ![]()
B. X��Y��Z��Ӧ�ķ�Ӧ��������(X) >��(Y) >��(Z)
C. X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX < KY <KZ
D. ����ѹǿ�������¶Ⱦ��������ϩ��ƽ��ת����
���𰸡�A
��������A. ��ͼ��֪��Y���Ӧ��ϩ��ƽ��ת����Ϊ20%����ʼn(C2H4) : n(H2O) =1:1����C2H4��H2O����ʼ���ʵ�����Ϊ1mol����������ʽ���У�
C2H4(g) + H2O(g) ![]() C2H5OH(g)
C2H5OH(g)
��ʼ��mol�� 1 1 0
ת����mol�� 0.2 0.2 0.2
ƽ����mol�� 0.8 0.8 0.2
��ƽ��ʱ�Ҵ������ʵ�������Ϊ�� ![]() =
=![]() ����A��ȷ��B. ��÷�Ӧ�����������С�Ŀ��淴Ӧ������ѹǿԽ����ϩ��ƽ��ת����Խ������ͼ��ɵã�P1��P2��P3����X��Y��Z�����Ӧ���¶�Խ��Խ�ߣ�����X��Y��Z��Ӧ�ķ�Ӧ��������(X) ����(Y) ����(Z)����B����C. ��ͼ��֪�������¶ȣ���ϩ��ƽ��ת���ʽ��ͣ�˵���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX �� KY ��KZ����C����D. ��÷�Ӧ�����������С�Ŀ��淴Ӧ����ѹǿԽ����ϩ��ƽ��ת����Խ������÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����ϩ��ƽ��ת���ʽ��ͣ���D����ѡA��
����A��ȷ��B. ��÷�Ӧ�����������С�Ŀ��淴Ӧ������ѹǿԽ����ϩ��ƽ��ת����Խ������ͼ��ɵã�P1��P2��P3����X��Y��Z�����Ӧ���¶�Խ��Խ�ߣ�����X��Y��Z��Ӧ�ķ�Ӧ��������(X) ����(Y) ����(Z)����B����C. ��ͼ��֪�������¶ȣ���ϩ��ƽ��ת���ʽ��ͣ�˵���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX �� KY ��KZ����C����D. ��÷�Ӧ�����������С�Ŀ��淴Ӧ����ѹǿԽ����ϩ��ƽ��ת����Խ������÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����ϩ��ƽ��ת���ʽ��ͣ���D����ѡA��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��T Kʱ����2.0 L�����ܱ������г���0.10 mol COCl2��������ӦCOCl2(g)![]() Cl2(g)��CO(g)������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
Cl2(g)��CO(g)������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
����˵����ȷ����( )
A. ���������������䣬�����¶ȣ�ƽ��ʱc(Cl2)��0.038 mol��L��1����Ӧ����H��0
B. ��Ӧ��ǰ2 s��ƽ������v(CO)��0.015 mol��L��1��s��1
C. ���������������䣬��ʼʱ�������г���0.12 mol COCl2��0.06 mol Cl2��0.06 mol CO����Ӧ�ﵽƽ��ǰ�����ʣ�v����v��
D. ���������������䣬��ʼʱ�������г���0.10 mol Cl2��0.08 mol CO���ﵽƽ��ʱ��Cl2��ת���ʴ���60%