题目内容
4.实验室提供一下流程提取海带中的碘.(1)海带需要置于坩埚(填仪器名称)中进行灼烧;
(2)步骤②中反应的离子方程式为2I-+H2O2+2H+=I2+2H2O;
(3)步骤③中应进行操作名称是萃取,使用的试剂是苯或四氯化碳;
(4)向加碘(主要以IO3-形式存在)食盐的溶液中加入适量硫酸酸化的FeSO4溶液,再滴加淀粉溶液,溶液变蓝色,其反应的离子方程式为2IO3-+10Fe2++12H+=I2+10Fe3++6H2O.

分析 根据题中的流程可知,干海带经过剪碎、灼烧成海带灰,再浸泡得海带灰悬浊液,经过过滤得含碘离子的溶液,在酸性条件下用双氧水氧碘离子氧化成碘单质,再用经过萃取得含碘有机溶液,再通过蒸馏可得晶态碘,
(1)根据实验操作灼烧来分析用到的实验仪器;
(2)H2O2具有较强的氧化性,在酸性条件下可氧化碘离子;
(3)从碘的水溶液中提取碘,可以用萃取,萃取剂的选择要满足:溶质在萃取剂中的溶解度大于原溶剂,原溶剂与萃取剂互不相溶;
(4)IO3-在酸性条件下能氧化的FeSO4溶液,生成碘,淀粉遇碘变蓝.
解答 解:根据题中的流程可知,干海带经过剪碎、灼烧成海带灰,再浸泡得海带灰悬浊液,经过过滤得含碘离子的溶液,在酸性条件下用双氧水氧碘离子氧化成碘单质,再用经过萃取得含碘有机溶液,再通过蒸馏可得晶态碘,
(1)灼烧固体物质一般使用(瓷)坩埚,
故答案为:坩埚;
(3)碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O;
(3)从碘的水溶液中提取碘,可以用萃取,而要将碘萃取出来,所使用的萃取剂要满足:溶质在萃取剂中的溶解度大于原溶剂,原溶剂与萃取剂互不相溶,故常用苯或四氯化碳来做萃取剂,
故答案为:萃取;苯或四氯化碳;
(4)IO3-在酸性条件下能氧化的FeSO4溶液,生成碘,淀粉遇碘变蓝,反应的离子方程式为2IO3-+10Fe2++12H+=I2+10Fe3++6H2O,
故答案为:2IO3-+10Fe2++12H+=I2+10Fe3++6H2O.
点评 本题主要考查从海带中提取碘的实验,明确物质的分离方法及碘单质的性质是解答的关键,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
14.下列说法正确的是( )
| A. | H(${\;}_{1}^{1}$H),D(${\;}_{1}^{2}$H),T(${\;}_{1}^{3}$H)表示三种氢原子 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 稀有气体元素最外层电子数均为8个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
15.下列有机化合物的分类不正确的是( )
| A. |  苯的同系物 | B. |  芳香化合物 | C. |  烯烃 | D. |  醇 |
12.利用化学反应Fe+CuSO4═FeSO4+Cu设计原电池,下列有关描述正确的是( )
| A. | Fe为正极 | B. | Cu为负极 | ||
| C. | 负极发生还原反应 | D. | 电解质溶液是CuSO4溶液 |
19.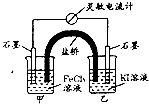 控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
 控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )| A. | 盐桥中的K+移向FeCl3溶液 | |
| B. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电级为负极 |
16.下列物质中,既有离子键,又含有共价键的是( )
| A. | C2H6 | B. | MgCl2 | C. | HNO3 | D. | NaOH |
13.元素是组成世界万物的基本成分,下列关于元素的说法不正确的是( )
| A. | 氯原子和氯离子都属于氯元素 | |
| B. | 合金中一定含有金属元素 | |
| C. | 人体缺铁元素会引起贫血 | |
| D. | 碳和碘元素都是人体不可缺少的微量元素 |
14.10g含有杂质的CaCO3和足量的盐酸反应,产生的CO2 0.1mol,则此样品中可能含有的杂质是( )
| A. | KHCO3和MgCO3 | B. | MgCO3和SiO2 | C. | K2CO3和 SiO2 |
