题目内容
(12分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:根据元素的结构和有关性质可知,A、B、C、D、E、F分别是H、C、O、Na、Al、S。
(1)F元素在周期表中的位置为 ,B的最高价氧化物电子式为 ,E元素的价层电子排布式为 。
(2)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式 ;
(4)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(1)F元素在周期表中的位置为 ,B的最高价氧化物电子式为 ,E元素的价层电子排布式为 。
(2)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式 ;
(4)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(1)第三周期第ⅥA族  3s23p1
3s23p1
(2)2A+8OH--6e-=2AlO2-+4H2O
(3)C(s)+1/2O2(g)=CO(g) H=-(a-2b)kJ/mol (4)8mol
 3s23p1
3s23p1 (2)2A+8OH--6e-=2AlO2-+4H2O
(3)C(s)+1/2O2(g)=CO(g) H=-(a-2b)kJ/mol (4)8mol
根据元素的结构和有关性质可知,A、B、C、D、E、F分别是H、C、O、Na、Al、S。
(1)S位于第三周期第ⅥA族;CO2中含有极性键,电子式为 ;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
(2)铝能和氢氧化钠溶液反应,所以负极是铝,方程式为2A+8OH--6e-=2AlO2-+4H2O。
(3)碳的燃烧热为a kJ/mol,则①C(s)+O2(g)=CO2(g) H=-akJ/mol;14gCO完全燃烧放出热量b kJ,所以有②CO(g)+1/2O2(g)=CO2(g) H=-2bkJ/mol。则根据盖斯定律可知①-②即得到C(s)+1/2O2(g)=CO(g) H=-(a-2b)kJ/mol。
(4)Al2S3和氢氧化钠反应的反应式为Al2S3+8NaOH=2NaAlO2+3Na2S+4H2O,所以消耗氢氧化钠是8mol。
(1)S位于第三周期第ⅥA族;CO2中含有极性键,电子式为
 ;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。(2)铝能和氢氧化钠溶液反应,所以负极是铝,方程式为2A+8OH--6e-=2AlO2-+4H2O。
(3)碳的燃烧热为a kJ/mol,则①C(s)+O2(g)=CO2(g) H=-akJ/mol;14gCO完全燃烧放出热量b kJ,所以有②CO(g)+1/2O2(g)=CO2(g) H=-2bkJ/mol。则根据盖斯定律可知①-②即得到C(s)+1/2O2(g)=CO(g) H=-(a-2b)kJ/mol。
(4)Al2S3和氢氧化钠反应的反应式为Al2S3+8NaOH=2NaAlO2+3Na2S+4H2O,所以消耗氢氧化钠是8mol。

练习册系列答案
相关题目
 ,C ,D 。
,C ,D 。 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。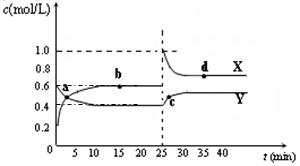
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
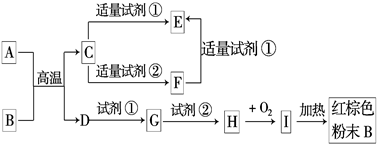
 ①甲+H2O H2↑+乙+丙↑
①甲+H2O H2↑+乙+丙↑  ②H2 + 丙 丁(气体)
②H2 + 丙 丁(气体)