题目内容
【题目】继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是
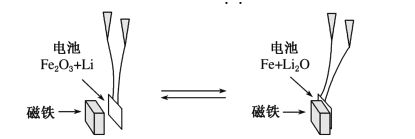
已知电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液一般由高纯度的有机溶剂、锂盐等原料组成
C.充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+
D.放电时,Li作电池的负极,Fe2O3作电池的正极
【答案】A
【解析】
由图可知该电池放电时负极反应式为Li-e-═xLi+,正极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe,充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,以此解答该题。
A.充电时,Fe作为阳极生成Fe2O3,充电完成时,铁完全转化为Fe2O3,磁铁不可吸引Fe2O3,故A错误;
B.锂属于活泼金属,会和水发生反应,所以不可以用电解质溶液作为电解液,一般由高纯度的有机溶剂、锂盐等原料组成,故B正确;
C.充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,则充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+,故C正确;
D.根据分析,放电时,Li作电池的负极,Fe2O3作电池的正极,故D正确;
答案选A。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目