题目内容
【题目】同温同压下,决定气体体积大小的因素是
A.气体分子间的平均距离B.气体分子的自身大小
C.气体分子的数目D.气体分子的数目和气体分子的自身大小
【答案】C
【解析】
气体的分子间距离远大于分子本身大小,决定气体体积的因素主要是气体的分子数目以及分子间距离,而同温同压下,气体分子间的平均距离一定时,气体物质的量的多少即气体的分子数目决定气体的体积大小,而与气体分子的直径、气体分子的式量无关,C项正确,
答案选C。

【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)2NH3(g)△H2=﹣92.4kJ/mol,有关数据及特定平衡状态见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,
起始时乙中的压强是甲容器的倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
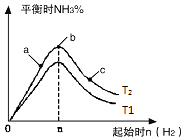
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2 , 3molH2 , 经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 . 保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2 , 达平衡后放出的热量为Q,则Q110.88kJ(填“>”、“<”或“=”).