题目内容
根据下列叙述,写出元素名称并画出原子结构示意图.
(1)A元素原子核外M层电子数是L层电子数的一半:
(2)B元素的原子最外层电子是次外层电子的两倍: ,写出B的两种常见同素异形体 .
(1)A元素原子核外M层电子数是L层电子数的一半:
(2)B元素的原子最外层电子是次外层电子的两倍:
考点:原子结构与元素的性质,原子结构示意图
专题:化学用语专题
分析:(1)A元素原子核外M层电子数是L层电子数的一半,则M层电子数为4,为Si元素,原子各层电子数分别为2、8、4;
(2)B元素的原子最外层电子是次外层电子的两倍,原子只能有2个电子层,最外层电子数为4,则B为C元素.
(2)B元素的原子最外层电子是次外层电子的两倍,原子只能有2个电子层,最外层电子数为4,则B为C元素.
解答:
解:(1)A元素原子核外M层电子数是L层电子数的一半,则M层电子数为4,为Si元素,原子各层电子数分别为2、8、4,原子结构示意图为 ,
,
故答案为: ;
;
(2)B元素的原子最外层电子是次外层电子的两倍,原子只能有2个电子层,最外层电子数为4,则B为C元素,原子结构示意图为 ,其两种常见同素异形体为:金刚石、石墨,
,其两种常见同素异形体为:金刚石、石墨,
故答案为: ;金刚石、石墨.
;金刚石、石墨.
 ,
,故答案为:
 ;
;(2)B元素的原子最外层电子是次外层电子的两倍,原子只能有2个电子层,最外层电子数为4,则B为C元素,原子结构示意图为
 ,其两种常见同素异形体为:金刚石、石墨,
,其两种常见同素异形体为:金刚石、石墨,故答案为:
 ;金刚石、石墨.
;金刚石、石墨.
点评:本题考查核外电子排布,难度不大,注意理解掌握原子结构示意图.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
两种短周期元素A、B,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法中不正确的是( )
| A、若a=b=3,8>m>n>5,则元素的非金属性:A>B |
| B、若8>m>3,n=1,则A与B可能形成共价化合物 |
| C、若a<b<m=n=4,则晶体类型相同时,由A、B形成的单质的熔点:B>A |
| D、若B的气态氢化物的化学式为BHn且n=4,则该氢化物为非极性分子 |
有等体积、等pH的稀硫酸,盐酸和醋酸三种酸溶液,滴加等度的氢氧化钠溶液将它们恰好中和,用去碱的体积分别为V1、V2、V3.则三者的大小关系正确的是( )
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V1=V2>V3 |
| D、V3>V2=V1 |
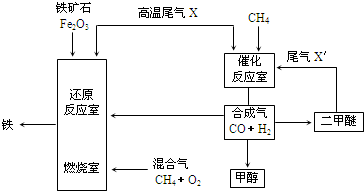
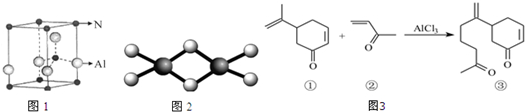
 (1)弱酸HA的电离常数 K=
(1)弱酸HA的电离常数 K=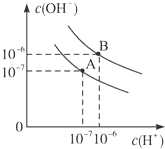 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: