题目内容
有等体积、等pH的稀硫酸,盐酸和醋酸三种酸溶液,滴加等度的氢氧化钠溶液将它们恰好中和,用去碱的体积分别为V1、V2、V3.则三者的大小关系正确的是( )
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V1=V2>V3 |
| D、V3>V2=V1 |
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:等pH的硫酸、盐酸和醋酸三种酸溶液,硫酸和HCl为强电解质,溶液中氢离子浓度相等,设氢离子浓度为c、溶液体积为V,则溶液中含有的氢原子的物质的量为cV,消耗氢氧化钠溶液的物质的量和体积相等;
而醋酸为弱电解质,溶液中部分电离出氢离子,则醋酸的浓度大于c,则醋酸的物质的量大于cV,用氢氧化钠中和时消耗的氢氧化钠的物质的量大于cV,据此进行判断V1、V2、V3的关系.
而醋酸为弱电解质,溶液中部分电离出氢离子,则醋酸的浓度大于c,则醋酸的物质的量大于cV,用氢氧化钠中和时消耗的氢氧化钠的物质的量大于cV,据此进行判断V1、V2、V3的关系.
解答:
解:等pH、等体积的硫酸、盐酸和CH3COOH三种酸溶液,设溶液中氢离子浓度为c、溶液体积为V,H2SO4和HCl为强电解质,两溶液中氢离子浓度相等,则溶液中含有的n(H+)=cV,消耗NaOH溶液的物质的量和溶液体积相等,即V1=V2;
CH3COOH为弱酸,CH3COOH溶液中只能部分电离出氢离子,则CH3COOH的浓度大于c,则醋酸溶液中n(CH3COOH)>n(H+)=cV,用NaOH溶液中和时消耗的NaOH溶液的物质的量大于cV,则消耗氢氧化钠溶液的体积关系为:V3>V2=V1,
故选D.
CH3COOH为弱酸,CH3COOH溶液中只能部分电离出氢离子,则CH3COOH的浓度大于c,则醋酸溶液中n(CH3COOH)>n(H+)=cV,用NaOH溶液中和时消耗的NaOH溶液的物质的量大于cV,则消耗氢氧化钠溶液的体积关系为:V3>V2=V1,
故选D.
点评:本题考查了酸碱混合的定性判断及溶液中氢离子、氢氧根离子与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液的pH的关系,明确弱电解质在溶液中只能部分电离是解答本题关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列实验装置中能达到实验目的是( )
A、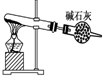 以NH4Cl为原料,如图装置可用于实验室制备少量NH3 |
B、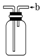 如图装置装满水后由b口进气可收集H2、NO等气体 |
C、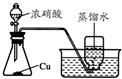 如图装置可用于制取、收集NO2 |
D、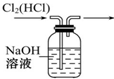 如图装置可用于除去Cl2中的HCl |
关于111号元素Rg的名称以及在元素周期表中的位置,正确的是( )
| A、錀 第七周期第ⅠB族 |
| B、镭 第七周期第ⅡA族 |
| C、金 第六周期第ⅠB族 |
| D、鎶 第七周期第ⅡB族 |
向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
| A、CO32- |
| B、Cl- |
| C、OH- |
| D、Cu2+ |
已知镁跟稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时HNO3的还原产物是( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
下列对于元素周期表结构的叙述中正确的是( )
| A、7个横行代表7个周期,18个纵行代表18个族 |
| B、副族元素中没有非金属元素 |
| C、除第1周期外,其他周期均有18种元素 |
| D、碱金属元素是指ⅠA族的所有元素 |
下列结论错误的是( )
①粒子半径:K+>Al3+>S2->Cl-
②离子的还原性:S2->Cl->Br->I-
③酸性:H2SO4>H3PO4>H2CO3>HClO
④非金属性:O>N>P>Si
⑤金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②离子的还原性:S2->Cl->Br->I-
③酸性:H2SO4>H3PO4>H2CO3>HClO
④非金属性:O>N>P>Si
⑤金属性:Be<Mg<Ca<K.
| A、只有① | B、①② |
| C、②④⑤ | D、①③⑤ |
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素原子的最外层电子排布是( )
| A、3s23p3 |
| B、2s22p5 |
| C、2s22p3 |
| D、3s23p5 |