题目内容
【题目】把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)![]() C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
A.D的平均速率为0.32mol/(L·min)
B.B的转化率为40%
C.增加B,B的平衡转化率升高
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
【答案】B
【解析】
设转化的A为xmol,则
2A(g)+2B(g)C(g)+2D(g)
开始(mol) 4 4 0 0
转化(mol) xx 0.5x x
平衡(mol) 4-x4-x0.5x x
经5min达到平衡,测得体系中C的体积分数为1/9,则![]() =
=![]() ,解得x=1.6mol。
,解得x=1.6mol。
A.D的平均速率为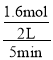 =0.16mol/(Lmin),故A错误;
=0.16mol/(Lmin),故A错误;
B.B的转化率为![]() ×100%=40%,故B正确;
×100%=40%,故B正确;
C.增加B,平衡正向移动,A的平衡转化率升高,B的平衡转化率减小,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选B。

 口算题天天练系列答案
口算题天天练系列答案【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,氧化性最强的单质是___,还原性最强的单质是___。
<>(2)最高价氧化物的水化物中碱性最强的是___,酸性最强的是___,呈两性的是___。(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___。
(4)在B、C、E、F、G、H中,原子半径最大的是___。
(5)用电子式表示B和H组成化合物的形成过程___,它属于___化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___。