题目内容
室温下,将0.1mol/L的H2 SO4溶液分别缓慢注入以下四种浓度均为0.1mol/L的溶液,各指标随加人H2 SO4溶液体积变化曲线图错误的是
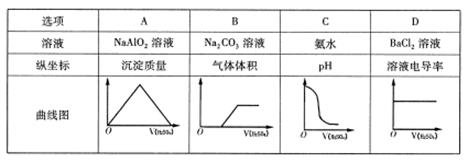

A、D
试题分析:A. 向NaAlO2溶液中加入H2SO4,首先发生反应:2NaAlO2+ H2SO4+2H2O= Na2SO4+2Al(OH)3↓.当H2SO4过量时又发生:3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O .前后消耗的硫酸的体积比为1:3.错误。B.向Na2CO3溶液中加入硫酸时首先发生反应:2Na2CO3+ H2SO4= Na2SO4+ 2NaHCO3;然后发生反应2NaHCO3+ H2SO4= Na2SO4+ H2O+ CO2↑。当溶液中所有生成的NaHCO3完全反应转化为Na2SO4时气体体积达到最大值,再加入硫酸也不产生气体。正确。C.氨水呈碱性,溶液的pH>7,当向溶液中加入H2SO4时发生酸碱中和反应:2NH3·H2O+ H2SO4= (NH4)2SO4+2H2O.当二者恰好发生中和反应时溶液的pH会有一个大的突变,然后就是H2SO4和(NH4)2SO4的混合溶液,显酸性,pH<7正确。D. 对于BaCl2溶液来说电离产生大量的Ba2+和Cl-,所有溶液能导电,当向溶液中加入H2SO4时,发生反应:BaCl2+ H2SO4=BaSO4↓+2HCl。溶液中导电的微粒为H+和Cl-.一个Ba2+的导电性与2个H+的导电能力相同,但由于溶液的体积增大,所以自由移动的离子的浓度减小,溶液的导电能力减弱。错误。

练习册系列答案
相关题目