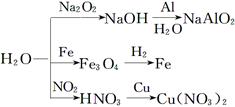
题目内容
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
(1)第二周期ⅥA族 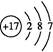 BCD
BCD
(2)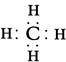
(3)NH4HCO3 或(NH4)2 CO3 H2NCH2COOH
(4)Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+
Fe(OH)2↓+2Fe(OH)3↓+8NH4+
(5)10-12
 BCD
BCD(2)
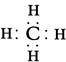
(3)NH4HCO3 或(NH4)2 CO3 H2NCH2COOH
(4)Fe2++2Fe3++8NH3+8H2O
 Fe(OH)2↓+2Fe(OH)3↓+8NH4+
Fe(OH)2↓+2Fe(OH)3↓+8NH4+(5)10-12
根据A、D可形成的两种液态化合物的情况知,这两种化合物为H2O和H2O2,再结合原子序数增大,所以A为H,D为O,则B只能为C,C为N,E单质可净化水质,E为Cl。
(1)O的原子序数是8,位于第二周期ⅥA族 ;氯元素位于第三周期ⅦA族,所以原子结构示意图为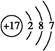 ;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
(2)由A、B两种元素组成的最简单的化合物是甲烷,电子式为 。
。
(3)都既可以与盐酸反应又可以与NaOH溶液反应,一般是弱酸的酸式盐或弱酸的铵盐或氨基酸,因此甲是碳酸氢铵或碳酸铵,乙是甘氨酸。化学式分别是NH4HCO3 或(NH4)2 CO3、H2NCH2COOH。
(4)①根据原子守恒可知,两种碱应该是氢氧化铁和氢氧化亚铁,所以方程式为Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
(5)亚铁离子和铁离子的浓度分别是2.0 mol·L-1和4.0 mol·L-1,所以根据溶度积常数可知,相应OH-浓度分别是10-8 mol·L-1、10-12 mol·L-1,所以混合液中c(OH-)不得大于10-12 mol·L-1。
(1)O的原子序数是8,位于第二周期ⅥA族 ;氯元素位于第三周期ⅦA族,所以原子结构示意图为
 ;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。(2)由A、B两种元素组成的最简单的化合物是甲烷,电子式为
 。
。(3)都既可以与盐酸反应又可以与NaOH溶液反应,一般是弱酸的酸式盐或弱酸的铵盐或氨基酸,因此甲是碳酸氢铵或碳酸铵,乙是甘氨酸。化学式分别是NH4HCO3 或(NH4)2 CO3、H2NCH2COOH。
(4)①根据原子守恒可知,两种碱应该是氢氧化铁和氢氧化亚铁,所以方程式为Fe2++2Fe3++8NH3+8H2O
 Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
Fe(OH)2↓+2Fe(OH)3↓+8NH4+。(5)亚铁离子和铁离子的浓度分别是2.0 mol·L-1和4.0 mol·L-1,所以根据溶度积常数可知,相应OH-浓度分别是10-8 mol·L-1、10-12 mol·L-1,所以混合液中c(OH-)不得大于10-12 mol·L-1。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目