题目内容
 A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,B元素的最高正化合价和最低负化合价的绝对值相等,E元素的原子最外层电子数是次外层的3倍.E和G可形成离子化合物GE.
A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,B元素的最高正化合价和最低负化合价的绝对值相等,E元素的原子最外层电子数是次外层的3倍.E和G可形成离子化合物GE.试回答下列问题:
(1)在点燃的条件下,G的单质与化合物BE2反应的方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(2)用电子式表示GE的形成过程
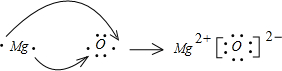
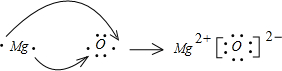
(3)写出在加热条件下B的单质与D的最高价氧化物的水化物的浓溶液反应的化学方程式
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
.(4)写出由上述元素中的四种元素形成的能溶于水的强电解质的化学式
(NH4)2CO3
(NH4)2CO3
(任写一种).(5)将由A分别与B、D、E组成的化合物按沸点由高到低的顺序写出它们的分子式
H2O、NH3、CH4
H2O、NH3、CH4
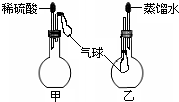
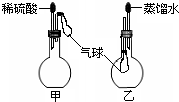
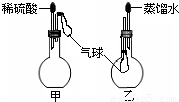
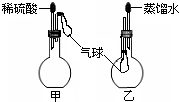
.(6)如图,烧瓶中装有由上述元素形成的化合物.挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则甲烧瓶中盛装的固体化合物的化学式可能为(任写一种)
MgCO3
MgCO3
,乙烧瓶中盛装的气体化合物的化学式可能为(任写一种)NH3
NH3
.分析:A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,则A为氢元素;E元素的原子最外层电子数是次外层的3倍,E原子有2个电子层,最外层电子数为6,故E为氧元素;B元素的最高正化合价和最低负化合价的绝对值相等,B元素原子最外层电子数为4,处于第ⅣA族,B原子序数小于氧元素,故B为碳元素;D的原子序数介于碳元素与氧元素之间,故D为氮元素;E和G可形成离子化合物GE,G元素原子形成为+2价离子,原子序数大于氧元素,故G为镁元素.
解答:解:A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,则A为氢元素;E元素的原子最外层电子数是次外层的3倍,E原子有2个电子层,最外层电子数为6,故E为氧元素;B元素的最高正化合价和最低负化合价的绝对值相等,B元素原子最外层电子数为4,处于第ⅣA族,B原子序数小于氧元素,故B为碳元素;D的原子序数介于碳元素与氧元素之间,故D为氮元素;E和G可形成离子化合物GE,G元素原子形成为+2价离子,原子序数大于氧元素,故G为镁元素.
(1)在点燃的条件下,Mg与在CO2中燃烧,生成氧化镁与碳,反应方程式为2Mg+CO2
2MgO+C.
故答案为:2Mg+CO2
2MgO+C.
(2)氧化镁是离子化合物,由镁离子与氧离子构成,用电子式表示MgO的形成过程为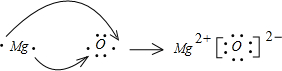 .
.
(3)在加热条件下碳与浓硝酸溶液反应生成二氧化碳、二氧化氮与水,反应化学方程式为C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
故答案为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
(4)由上述元素中的四种元素形成的能溶于水的强电解质有(NH4)2CO3等.
故答案为:(NH4)2CO3.
(5)将由A分别与B、D、E组成的化合物分别为CH4、NH3、H2O,常温下水是液态,甲烷、氨气为气态;氨气分子之间存在氢键,沸点比甲烷高,所以沸点由高到低的顺序为H2O、NH3、CH4.
故答案为:H2O、NH3、CH4.
(6)烧瓶中装有由上述元素形成的化合物.挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则硫酸与甲烧瓶中盛装的固体化合物反应生成气体,该固体化合物可以为MgCO3等;乙烧瓶中盛装的气体,易溶于水,可以为NH3等.
故答案为:MgCO3;NH3.
(1)在点燃的条件下,Mg与在CO2中燃烧,生成氧化镁与碳,反应方程式为2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(2)氧化镁是离子化合物,由镁离子与氧离子构成,用电子式表示MgO的形成过程为
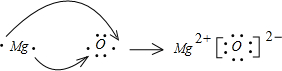 .
.(3)在加热条件下碳与浓硝酸溶液反应生成二氧化碳、二氧化氮与水,反应化学方程式为C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
故答案为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
(4)由上述元素中的四种元素形成的能溶于水的强电解质有(NH4)2CO3等.
故答案为:(NH4)2CO3.
(5)将由A分别与B、D、E组成的化合物分别为CH4、NH3、H2O,常温下水是液态,甲烷、氨气为气态;氨气分子之间存在氢键,沸点比甲烷高,所以沸点由高到低的顺序为H2O、NH3、CH4.
故答案为:H2O、NH3、CH4.
(6)烧瓶中装有由上述元素形成的化合物.挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则硫酸与甲烧瓶中盛装的固体化合物反应生成气体,该固体化合物可以为MgCO3等;乙烧瓶中盛装的气体,易溶于水,可以为NH3等.
故答案为:MgCO3;NH3.
点评:考查结构与位置关系、电子式、元素化合物性质与结构等,难度中等,推断元素是解题关键,注意基础知识的全面掌握.

练习册系列答案
相关题目

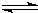 NH4++OH-
NH4++OH-