题目内容
(8分)X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
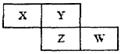
若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z元素形成的氢化物的沸点高低比较为 ,原因是 。
(3)含X元素的四核10电子微粒的电子式为 。
(4)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 。
(5)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。

若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z元素形成的氢化物的沸点高低比较为 ,原因是 。
(3)含X元素的四核10电子微粒的电子式为 。
(4)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 。
(5)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。
(1)第三周期,第ⅦA族;(2)H2O>H2S,水分子之间存在着氢键;(3)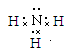
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (5)4HClO4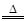 2Cl2↑+7O2↑+2H2O
2Cl2↑+7O2↑+2H2O
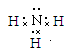
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (5)4HClO4
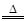 2Cl2↑+7O2↑+2H2O
2Cl2↑+7O2↑+2H2O试题分析:Z原子的最外层电子数是电子层数的2倍以及Z在周期表中的位置,则Z是S,W是Cl,X是N,Y是O。W最高价氧化物水化物为HClO4,受热分解时,当有28 mol电子转移时共产生9 mol气体,根据化合价的变化可知生成Cl2 2mol,则其余7mol为O2,所以方程式为:4HClO4
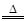 2Cl2↑+7O2↑+2H2O。
2Cl2↑+7O2↑+2H2O。点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目

