题目内容
化学兴趣小组用如图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.(已知:二溴乙烷密度2.18g?cm-3,不易溶于水,易溶于醇、醚、丙酮等有机溶剂).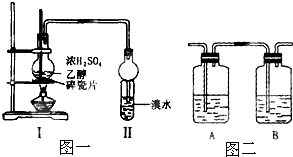
请回答下列问题:
(1)该实验中生成乙烯的化学方程式:
(2)甲同学认为:该混合液体反应复杂,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性.下列理由中正确的是
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙酸,也会使溴水褪色
(3)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加了如图二所示装置.则A中的试剂应为
(4)丙同学经过观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是:
(5)处理上述实验后烧瓶中废液,最合理的方法是
A.废液经冷却后倒入下水道中
B.废液倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道.
分析:(1)乙醇在浓硫酸做催化剂和脱水剂的作用下发生消去反应生成乙烯;
(2)浓H2SO4具有强氧化性,能将乙醇氧化成碳,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)在Ⅰ和Ⅱ之间增加图2装置,A装置盛有氢氧化钠溶液目的是为了除去反应生成的SO2和CO2,B装置盛有品红溶液目的是为了检验SO2是否除尽;
(4)反应生成的乙烯与试管中的溴水加成反应生成不溶于水的油状物质;如果发生取代反应生成物含有HBr,溶液酸性增强;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要进行处理.
(2)浓H2SO4具有强氧化性,能将乙醇氧化成碳,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)在Ⅰ和Ⅱ之间增加图2装置,A装置盛有氢氧化钠溶液目的是为了除去反应生成的SO2和CO2,B装置盛有品红溶液目的是为了检验SO2是否除尽;
(4)反应生成的乙烯与试管中的溴水加成反应生成不溶于水的油状物质;如果发生取代反应生成物含有HBr,溶液酸性增强;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要进行处理.
解答:解:(1)乙醇消去生成乙烯和水化学方程式为:CH3CH2OH
CH2=CH2↑+H2O;
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4
CO2↑+2SO2↑+2H2O
SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)A装置盛有氢氧化钠溶液目的是为了除去反应生成的SO2和CO2,B装置盛有品红溶液目的是为了检验SO2是否除尽;
(4)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
故答案为:试管底层有油状物质生成;如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,废液倒入盛有水的塑料桶中,经处理后再倒入下水道,
故答案为:D.
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4
| ||
SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)A装置盛有氢氧化钠溶液目的是为了除去反应生成的SO2和CO2,B装置盛有品红溶液目的是为了检验SO2是否除尽;
(4)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
故答案为:试管底层有油状物质生成;如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,废液倒入盛有水的塑料桶中,经处理后再倒入下水道,
故答案为:D.
点评:本题考查了乙烯的实验室制法,注意结合浓硫酸、乙烯的性质来分析解答,注意题(2)考虑浓硫酸的强氧化性,使乙醇碳化反应生成二氧化硫,二氧化硫具有强的还原性,与溴水发生氧化还原反应,使溴水褪色.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
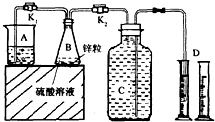 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对分子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对分子质量.