题目内容
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)△H=a kJmol﹣1 .
N2(g)+2CO2(g)△H=a kJmol﹣1 .
(1)已知:2NO(g)+O2(g)=2NO2(g)△H=b kJmol﹣1;CO的燃烧热为c kJmol﹣1 . 写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式 .
(2)一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/molL﹣1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
c(CO)/molL﹣1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |
①在恒容密闭容器中充入CO,NO气体,下列图象如图1正确且能说明反应达到平衡状态的是 . 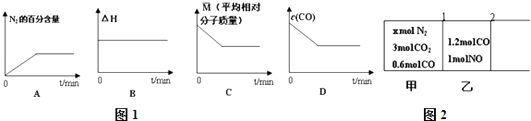
②前2s内的平均反应速率υ(N2)=mol/(Ls)(保留两位小数,下同);此温度下,该反应的平衡常数为 .
③采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液.已知常温下,该溶液的PH=5,则 ![]() =(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体,
=(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体, ![]() 的值将(填“变大”、“不变”或“变小”).
的值将(填“变大”、“不变”或“变小”).
(3)如图2所示,用无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下达到平衡时,各部分体积分别为V甲、V乙 . 此时若去掉活塞1,不引起活塞2的移动.则x= , V甲:V乙= .
【答案】
(1)2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a﹣b+2c kJ?mol﹣1
(2)AD;0.09;0.03mol?L﹣1;1.7×104;变大
(3)1.5;3:1
【解析】解:(1)已知①2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)△H=a kJmol﹣1②2NO(g)+O2(g)=2NO2(g)△H=b kJmol﹣1;③CO(g)+0.5O2(g)=CO2(g)△H=c kJmol﹣1根据盖斯定律①﹣②+2×③可得2NO2(g)+4CO(g)=N2(g)+4CO2(g))△H=a﹣b+2c kJmol﹣1;
N2(g)+2CO2(g)△H=a kJmol﹣1②2NO(g)+O2(g)=2NO2(g)△H=b kJmol﹣1;③CO(g)+0.5O2(g)=CO2(g)△H=c kJmol﹣1根据盖斯定律①﹣②+2×③可得2NO2(g)+4CO(g)=N2(g)+4CO2(g))△H=a﹣b+2c kJmol﹣1;
所以答案是:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a﹣b+2c kJmol﹣1;(2)①A、随着反应的进行,氮气的百分量瞪大,平衡时不再变化,故A正确;
B、△H与反应的物质的量有关,故△H改变,与图象不符,故B错误;
C、混合我替的总质量不变,该反应的混合气体的总的物质的量变小,根据 ![]() =
= ![]() ,平均相对分子质量增大,平衡时不再改变,故C错误;
,平均相对分子质量增大,平衡时不再改变,故C错误;
D、CO作为反应物,随着反应的进行,浓度减小,平衡时保持不变,故D正确;
故选AD;②从表可知2s内NO浓度变化量为0.36molL﹣1 , 则N2的浓度为0.18mol/L,故其速率为 ![]() =0.09molL﹣1min﹣1;平衡后四种物质平衡浓度为0.5molL﹣1、3molL﹣1、0.25molL﹣1、0.5molL﹣1 , 故平衡常数K=
=0.09molL﹣1min﹣1;平衡后四种物质平衡浓度为0.5molL﹣1、3molL﹣1、0.25molL﹣1、0.5molL﹣1 , 故平衡常数K= ![]() =0.03molL﹣1;
=0.03molL﹣1;
所以答案是:0.09; 0.03molL﹣1;③水解平衡常数Kh= ![]() =
= ![]()
![]() =
= ![]() ,pH=5,c(H+)=1×10﹣5 , 则
,pH=5,c(H+)=1×10﹣5 , 则 ![]() =
= ![]() =
= ![]() =10﹣5×
=10﹣5× ![]() =1.7×104;
=1.7×104;
在(NH4)2SO4溶液中存在水解反应,2NH4++H2ONH3H2O+H+ , 往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以 ![]() 的值将变大;
的值将变大;
所以答案是:1.7×104;变大;
·(3)如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)N2(g)+2CO2(g)只要转化到一边成比例即等效,所以有
2CO(g)+ | 2NO(g) | N2(g)+ | 2CO2(g) | ||
甲起始(mol): | 0.6 | 0 | x | 3 | |
转化(mol): | 0.6+2x | 2x | 0 | 3﹣2x | |
乙起始(mol): | 1.2/p> | 1 | 0 | 0 |
若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,则3﹣2x=0,解得x=1.5mol,
则甲相等于3.6molCO和3molNO刚好是乙的3倍,所以V甲:V乙=3:1;
所以答案是:1.5;3:1.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡状态的判断,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.