题目内容
某校化学兴趣小组的同学欲测定某种品牌味精中食盐的含量.下面是该小组所做的有关实验步骤:
①称取某品牌袋装味精样品10.0g放入烧杯中,并加适量蒸馏水溶解;
②
③
④用蒸馏水洗涤沉淀2-3次;
⑤将沉淀干燥、称量,测得固体质量4.9g.
根据上述实验步骤回答下列问题:
(1)补齐所缺少的实验步骤:②______,③______;
(2)实验步骤③所用的玻璃仪器有:______;
(3)若味精标签上标注:“谷氨酸钠含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?
______ (填“合格”,“不合格”).
解:(1)实验原理:氯化钠与硝酸银反应生成氯化银沉淀的质量,计算出氯化钠的质量,再用氯化钠的质量除以袋装味精样品的质量即可,故答案为:②加入足量稀硝酸和硝酸银溶液.③过滤.
(2)过滤操作用到的仪器主要有漏斗(滤纸)、烧杯、玻璃棒、铁架台(铁圈),故答案为:漏斗(滤纸)、烧杯、玻璃棒;
(3)设:生成4.9g氯化银需要参加反应的氯化钠的质量为X则:
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
X 4.9g
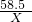 =
=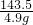 解得X=2.0g;
解得X=2.0g;
NaCl含量为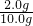 ×100%=20%,此样品是符合产品标示的质量分数,故答案为:合格.
×100%=20%,此样品是符合产品标示的质量分数,故答案为:合格.
分析:(1)根据实验原理:氯化钠与硝酸银反应生成氯化银沉淀的质量,计算出氯化钠的质量,再用氯化钠的质量除以袋装味精样品的质量即可;
(2)根据过滤用到的仪器进行分析,
(3)根据方程式AgNO3+NaCl═AgCl↓+NaNO3求出氯化钠的质量,最后求食盐的含量;
点评:解答本题的关键是要知道所得固体质量4.9g为生成的氯化银沉淀的质量,再利用氯化银沉淀的质量通过方程式计算出氯化钠的质量,再进一步进行计算.
(2)过滤操作用到的仪器主要有漏斗(滤纸)、烧杯、玻璃棒、铁架台(铁圈),故答案为:漏斗(滤纸)、烧杯、玻璃棒;
(3)设:生成4.9g氯化银需要参加反应的氯化钠的质量为X则:
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
X 4.9g
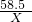 =
=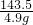 解得X=2.0g;
解得X=2.0g;NaCl含量为
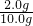 ×100%=20%,此样品是符合产品标示的质量分数,故答案为:合格.
×100%=20%,此样品是符合产品标示的质量分数,故答案为:合格.分析:(1)根据实验原理:氯化钠与硝酸银反应生成氯化银沉淀的质量,计算出氯化钠的质量,再用氯化钠的质量除以袋装味精样品的质量即可;
(2)根据过滤用到的仪器进行分析,
(3)根据方程式AgNO3+NaCl═AgCl↓+NaNO3求出氯化钠的质量,最后求食盐的含量;
点评:解答本题的关键是要知道所得固体质量4.9g为生成的氯化银沉淀的质量,再利用氯化银沉淀的质量通过方程式计算出氯化钠的质量,再进一步进行计算.

练习册系列答案
相关题目