题目内容
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
则下列分析推理中不正确的是 ( )
A.根据表中数据不能计算出混合物中NaHCO3的质量分数
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0mol·L-1
D.15.7 g混合物恰好与盐酸完全反应
| | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
A.根据表中数据不能计算出混合物中NaHCO3的质量分数
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0mol·L-1
D.15.7 g混合物恰好与盐酸完全反应
AD
9.2g混合物与50mL盐酸反应生成2.24L CO2,则生成3.36L CO2气体需混合的质量为13.8 g,所以D错误,同时可知B正确;根据第一组数据50mL盐酸与9.2g混合物反应生成2.24L CO2,可计算出NaHCO3的质量分数,解题过程如下:
设:9.2g混合物中NaHCO3的物质的量为x,KHCO3的物质的量为y
则:84x+100y=9.2
X+y=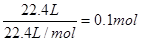 得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
设:9.2g混合物中NaHCO3的物质的量为x,KHCO3的物质的量为y
则:84x+100y=9.2
X+y=
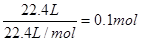 得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目