题目内容
在标准状况下,用10.5m3的氨气跟足量的空气反应生成硝酸,从所得硝酸中取出质量的1%,加水到3000mL,测得稀硝酸的密度为1.05g×cm-3,浓度的质量分数为6%。再取此稀硝酸50mL,将1.5g含杂质的铜投入到50mL稀硝酸中,两者正好完全反应(铜中杂质不跟硝酸反应)。(1)求氨气的利用率。
(2)求铜的纯度。
答案:
解析:
解析:
| 解法一:用物质的量计算
1m3=103L,3000mL=3L 标准状况下氨气的体积换算成物质的量:
总质量的1%的硝酸溶液中,含溶质硝酸物质的量:
稀硝酸的物质的量浓度: 10.5m3氨气氧化生成的硝酸总物质的量: 3mol´100倍=300mol (1)氨的利用率 氨氧化制硝酸NH3→NO→NO2→HNO3,若氮不损失NH3~HNO3,生成300mol HNO3,氨气的利用率:
(2)铜的纯度:设跟硝酸反应的铜xg 3Cu + 8HNO3═3Cu(NO3)2+2NO↑+4H2O 3´64g 8mol x g 0.05´lmol×L-1 3´64∶x=8∶0.05 解得:x=1.2
解法二:用质量计算 把10.5´<&/span>103L氨气换算成质量,把稀硝酸换算成质量,原理和解法一相同。
|

练习册系列答案
相关题目
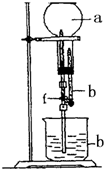 为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:
为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题: