题目内容
常温时,有浓度均为0.1 mol/L的四种溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水,下列有关说法不正确的是( )
| A.上述溶液中,既能与NaOH反应,又能与H2SO4反应的溶液中离子浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| B.向④中加入少量的NH4Cl固体,此时溶液中c(NH4+)/c(OH-)的值增大 |
| C.若将③和④的溶液混合后,溶液恰好呈中性,则混合前溶液的体积为③<④ |
| D.取10 mL溶液③,加水稀释到100 mL,此时溶液中由水电离的c(H+) = 1×10-12mol/L |
A
A项中能与NaOH和H2SO4反应的溶液就是NaHCO3溶液,显碱性,说明HCO3-的水解大于电离,所以离子浓度大小应为c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),所以A不正确。向④中加入少量的NH4Cl固体,c(NH4+)增大,平衡左移,c(OH-)减小,所以c(NH4+)/c(OH-)的值增大,B正确。③和④的溶液混合后,溶液恰好呈中性,则④过量,所以体积为③<④,C正确。③溶液稀释10倍,c(H+) = 1×10-2mol/L,由水的离子积可知由水电离的c(H+) = 1×10-12mol/L,D项正确。

练习册系列答案
相关题目
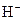 浓度也是醋酸中的两倍
浓度也是醋酸中的两倍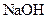 溶液和氨水各稀释一倍,两者的
溶液和氨水各稀释一倍,两者的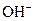 浓度均减小到原来的
浓度均减小到原来的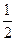
 、Cl-
、Cl-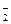 、NO
、NO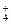 、K+、Cl-、NO
、K+、Cl-、NO