题目内容
【题目】下列图示与对应的叙述相符的是( )
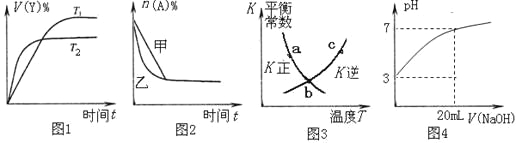
A. 图1表示可逆反应“2X(g)![]() Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B. 图2表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C. 图3中a、b、c三点中只有b点已经达到化学平衡状态
D. 图4是向20 mL pH =3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
【答案】A
【解析】A.由图可知,温度T2先到达平衡,故温度T1<T2,可逆反应2X(g)Y(g)△H<0,正反应为放热反应,升高温度平衡向逆反应移动,Y的含量降低,图象与实际相符合,故A正确;B.增大压强反应速率加快,平衡向正反应移动,平衡时A的物质的量降低,图象中到达平衡时间相同,且平衡时A的物质的量相同,图象与实际不符合,故B错误;C.图象为正、逆平衡常数与温度关系,曲线上各点都是平衡点,故C错误;D.20mLpH=3的醋酸溶液中滴加20mLpH=11的NaOH溶液,由于HAc是弱电解质,反应后为HAc、NaAc混合溶液,HAc浓度远大于NaAc,溶液呈酸性,图象中为中性,图象与实际不符,故D错误;故选A。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都具有10个电子,其结构特点如下:
粒子代码 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c和f在一定条件下形成一个g分子和一个d分子,试写出:
(1)a粒子的原子结构示意图___________
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为___>_____ (用化学式表示)。
(3)d与一种含有极性键双核18电子分子反应的化学方程式为 ______。
(4)g与一种含有非极性键双核18电子分子反应的化学方程式为__________
上述反应中,断裂化学键是__________,写出的化学键是________(填“离子键”、“极性键”、“非极性键”、“氢键”)