题目内容
(1)5molCO2的质量是______;在标准状况下所占的体积约为______;所含的分子数目约为______;所含氧原子的数目约为______.
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是______,X的相对原子质量是______,该物质的化学式为______.
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
______+Na2SO3+______→Na2SO4+______+______+H2O
②反应物中发生氧化反应的物质是______(填化学式),被还原的元素是______.
解:(1)m=nM=5mol×44g/mol=220g、V=nVm=5mol×22.4L/mol=112L、N=nNA=5mol×6.02×1023=3.01×1024(5NA)、氧原子数是分子数的2倍,即为6.02×1024 (10NA),
故答案为:220g;112L;3.01×1024(5NA);6.02×1024 (10NA);
(2)钠离子的物质的量是Na2X的2倍,所以Na2X的物质的量是0.2mol,据M=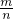 =
=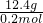 =62g/mol,物质的摩尔质量在数值上等于其相对分子质量,
=62g/mol,物质的摩尔质量在数值上等于其相对分子质量,
X的相对原子质量=相对分子质量-2×23=16,所以为Na2O,故答案为:62g/mol;16;Na2O;
(3)①反应中亚硫酸钠中硫元素化合价升高,做还原剂,所以化合价能降低的KIO3来做氧化剂,对应的还原产物是单质碘,然后根据化合价升高和降低的数目相等来配平方程式,
故答案为:Na2SO3+KIO3+H2SO4→Na2SO4+I2+K2SO4+H2O;
②还原剂是Na2SO3,发生氧化感应,碘元素化合价降低,被还原,故答案为:Na2SO3;I.
分析:(1)根据m=nM、V=nVm、N=nNA来计算;
(2)物质的摩尔质量在数值上等于其相对分子质量,据公式M=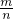 来计算;
来计算;
(3)①根据氧化还原反应中得失电子数相等来配平方程式;
②还原剂发生氧化反应,化合价降低的元素被还原.
点评:本题考查学生氧化还原反应中的有关概念以及转移电子的知识,可以根据所学知识进行回答,难度不大.
故答案为:220g;112L;3.01×1024(5NA);6.02×1024 (10NA);
(2)钠离子的物质的量是Na2X的2倍,所以Na2X的物质的量是0.2mol,据M=
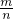 =
=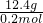 =62g/mol,物质的摩尔质量在数值上等于其相对分子质量,
=62g/mol,物质的摩尔质量在数值上等于其相对分子质量,X的相对原子质量=相对分子质量-2×23=16,所以为Na2O,故答案为:62g/mol;16;Na2O;
(3)①反应中亚硫酸钠中硫元素化合价升高,做还原剂,所以化合价能降低的KIO3来做氧化剂,对应的还原产物是单质碘,然后根据化合价升高和降低的数目相等来配平方程式,
故答案为:Na2SO3+KIO3+H2SO4→Na2SO4+I2+K2SO4+H2O;
②还原剂是Na2SO3,发生氧化感应,碘元素化合价降低,被还原,故答案为:Na2SO3;I.
分析:(1)根据m=nM、V=nVm、N=nNA来计算;
(2)物质的摩尔质量在数值上等于其相对分子质量,据公式M=
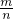 来计算;
来计算;(3)①根据氧化还原反应中得失电子数相等来配平方程式;
②还原剂发生氧化反应,化合价降低的元素被还原.
点评:本题考查学生氧化还原反应中的有关概念以及转移电子的知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目