题目内容
4.汤姆孙提出原子的葡萄干面包模型的主要依据是( )①原子的构成中有电子 ②原子的构成中有质子 ③原子的构成中有中子 ④整个原子是电中性的.
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②④ |
分析 汤姆孙根据实验发现了电子,而且原子呈电中性,据此提出原子的葡萄干面包模型.
解答 解:汤姆孙根据实验发现了电子,而且原子呈电中性,说明原子的构成中含有带正电荷的质子,依此提出原子的葡萄干面包模型;
故选B.
点评 本题考查了汤姆孙原子模型的理论依据,侧重于原子结构的考查,题目难度不大.

练习册系列答案
相关题目
14.已知:在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如表.
随着卤素原子核电荷数的增加,仅依据K的变化,下列说法不正确的是( )
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 42 | 34 |
| A. | 已知t2>t1,HX的生成反应是放热反应 | |
| B. | 在相同条件下,平衡时X2的转化率逐渐降低 | |
| C. | X2与H2反应的剧烈程度逐渐减弱 | |
| D. | HX的稳定性逐渐减弱 |
15.在固定体积的密闭容器中加入4mol A和2mol B发生如下反应2A(g)+B(g)?3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是( )
| A. | 2molA+1molB | B. | 2molA+1molB+3molC+1mol D | ||
| C. | 3molC+1molD | D. | 4molA+2molB+3molC |
12.下列每组的物理量,不能求物质的量的是( )
| ① | ② | ③ | ④ | ⑤ |
| 物质的粒子数 | 标准状况下气体摩尔体积 | 固体体积 | 溶质的质量分数 | 非标准状况物质的质量 |
| 阿伏加德罗常数 | 标准状况气体体积 | 固体密度 | 溶液的体积 | 物质的 摩尔质量 |
| A. | ①③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
19.实验室中需配制 2mol•L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 1000 mL,111.2 g | B. | 950 mL,111.2 g | ||
| C. | 任意规格,117.0 g | D. | 1000 mL,117.0 g |
9.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | Al与稀H2SO4:Al+2H+→Al3++H2↑ | |
| C. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++2H2O | |
| D. | 氯化铝溶液中加氨水:Al3++3OH-→Al(OH)3↓ |
16.在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+,改变条件,填写表(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
7.分别放在0.1mol•L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是( )
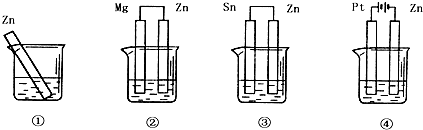

| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
