题目内容
【题目】室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.l mol·L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是
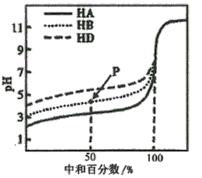
A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系:pH(NaA)>pH(NaB)>PH(NaD)
B.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【答案】C
【解析】
浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,酸越弱,电离出的H+越少,起始时pH值越大,根据图象,则三种酸的强弱为:HA>HB>HD。
A、浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,酸越弱,电离出的H+越少,起始时pH值越大,根据图象,则三种酸的强弱为:HA>HB>HD,酸越强,电离出的H+越多,对水的抑制作用越大,则三种溶液中,由水电离产生的c(H+)的关系为:HA<HB<HD,故A错误;
B、滴定至P点时,此时中和百分数为50%,对于HB溶液,此时溶液中的起始组分为c(HB):c(NaB)=1:1,显酸性,则c(H+)>c(OH-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(B-),由于c(H+)>c(OH-),则c(B-)>c(Na+),考虑到溶液显酸性,则以HB的电离为主导,但始终是微弱的,而HB的电离又会抑制水的电离,因此c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C、pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,对于HA溶液,c(Na+)=c(A-),对于HB溶液,c(Na+)=c(B-),对于HD溶液,c(Na+)=c(D-),由图可知,中和到相同pH时,中和分数HA>HB>HD,即加入氢氧化钠的量HA>HB>HD,则三种溶液中:c(A-)>c(B-)>c(D-),故C正确;
D、当中和百分数达100%时,三种溶液分别恰好存在等量的NaA、NaB、NaD,三种溶液混合,则起始时c(NaA):c(NaB):c(NaD)=1:1:1,根据质子守恒,c(HA)+ c(HB)+ c(HD)+c(H+)=c(OH- ),则有c(HA)+ c(HB)+ c(HD)=c(OH-)-c(H+),故D错误;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________






