题目内容
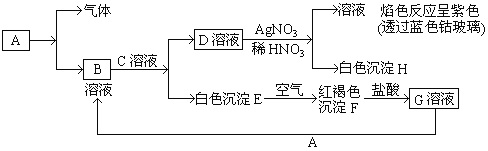
【题目】有A、B、C、D、E、F 六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6 L H2,E的阳离子与A的阴离子核外电子层结构完全相同,F原子半径在短周期元素中最大,回答下列问题:
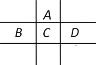
(1)元素的名称:B_____________;
(2)画出C离子的结构示意图:______________;
(3)写出D元素在周期表中的位置:__________;D元素的单质可用于制漂白液和漂白粉,写出制漂白液的离子方程式:____________,漂白粉的有效成分是______________;
(4)B的同族上一周期元素的氢化物为__________(化学式) ,实验室制取该物质的方程式为_________,制取该气体时用______________做干燥剂。
【答案】磷 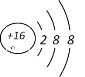 第三周期第ⅦA族 Cl2+2OH-=Cl-+ClO-+H2O Ca(ClO)2 NH3 Ca(OH)2+2NH4Cl
第三周期第ⅦA族 Cl2+2OH-=Cl-+ClO-+H2O Ca(ClO)2 NH3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3 ↑+2H2O 碱石灰
CaCl2+2NH3 ↑+2H2O 碱石灰
【解析】
A、B、C、D四种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=![]() ,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,F原子半径在短周期元素中最大,则F是Na元素。然后利用元素及其单质、化合物的性质解答。
,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,F原子半径在短周期元素中最大,则F是Na元素。然后利用元素及其单质、化合物的性质解答。
根据上述分析可知A、B、C、D、E、F表示的元素分别是O、P、S、Cl、Al、Na。
(1)B表示的元素是P,元素的名称磷;
(2) C是S元素,S原子获得2个电子,达到最外层8个电子的稳定结构,所以S2-的结构示意图: ;
;
(3)D表示的是Cl元素,在周期表中的位置是第三周期第VIIA;Cl2与石灰乳反应制取漂白粉,漂白粉的成分是氯化钙、次氯酸钙,有效成分是次氯酸钙,Cl2与NaOH溶液反应产生NaCl、NaClO和水,所得溶液含有强氧化性的NaClO,因而具有漂白性,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(4) B是P,与B在同族上一周期元素是N,N元素的氢化物为NH3,在实验室中是用NH4Cl与Ca(OH)2混合加热制取的,制取该物质的方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3 ↑+2H2O,氨气是碱性气体,可以用碱性干燥剂碱石灰来干燥。
CaCl2+2NH3 ↑+2H2O,氨气是碱性气体,可以用碱性干燥剂碱石灰来干燥。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是___________。
(2)如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是_____。

A.a电极是负极
B.b电极的电极反应为4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据氢氧燃料电池电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应 | ______________ | |
正极反应 | ___________ | |
溶液的pH变化 | _____________ |
(4)若把H2改为CH4,KOH溶液作电解质溶液,则负极反应为_________________________________________。