题目内容
【题目】(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H = _____kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
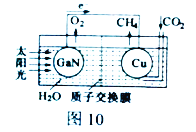
①写出铜电极表面的电极反应式_____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
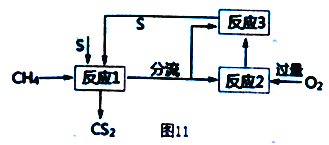
①写出发生反应1的化学反应方程式___________。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________。
【答案】 a+2b-2c CO2+8e-+8H+=CH4+2H2O 硫酸 2NH4HS+O2=2S↓+2NH3·H2O CH4+4S=CS2+2H2S 1:2 1mol
【解析】试题分析:本题考查盖斯定律的应用,电极反应式的书写,指定情境下方程式的书写,含S化合物之间的转化,物质的量应用于化学方程式的计算。
(1)将反应编号,CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=akJ/mol(①式)
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=bkJ/mol(②式)
2CO(g)+O2(g)=2CO2(g) △H3=ckJ/mol(③式)
应用盖斯定律,将①式+②式![]() 2-③式
2-③式![]() 2,得CO2(g)+CH4(g)=2CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol。
2,得CO2(g)+CH4(g)=2CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol。
(2)①根据装置图中电子的流向和物质的流向,Cu电极表面上CO2得电子被还原成CH4,CO2中C元素的化合价为+4价,CH4中C元素的化合价为-4价,1molCO2得8mol电子生成1molCH4,结合质子交换膜,Cu电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O。
②GaN材料上的电极反应式为:4OH--4e-=O2↑+2H2O。为提高该人工光合系统的工作效率,可向装置中加入少量硫酸,不能加入盐酸,若加入盐酸,放电能力:Cl-![]() OH-,GaN表面Cl-优先放电产生Cl2。
OH-,GaN表面Cl-优先放电产生Cl2。
(3)根据题意,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,即NH4HS溶液与空气作用生成S和氨水,再生反应的化学方程式为:2NH4HS+O2=2S↓+2NH3·H2O。
(4)由流程知,反应1的反应物为CH4和S,反应1产生两种含硫的物质,生成物为CS2和H2S;生成的H2S一部分与过量O2作用发生反应2生成SO2,反应2生成的SO2与另一部分H2S发生反应3生成S,S循环利用。
①反应1的化学方程式为:CH4+4S=CS2+2H2S。
②反应2的化学方程式为:2H2S+3O2=2SO2+2H2O;反应3的化学方程式为:2H2S+SO2=3S↓+2H2O;为了充分利用S,进入反应2和反应3的气体物质的量之比为1:2。
③根据反应,反应1中每有1molCS2生成,同时生成2molH2S,2molH2S中进入反应2的为2mol![]() =
=![]() mol,则反应2消耗的O2为
mol,则反应2消耗的O2为![]() n(H2S)=1mol。
n(H2S)=1mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

