题目内容
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠可作为碱使用的原因是_______________________________(用离子方程式表示)。
(2)写出碳酸钠溶液的物料守恒式____________________________________________。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
(4)已知室温时,Ksp[Mg(OH)2]=4.0×1011。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3) 。
【答案】 CO32-+H2OHCO3-+OH- c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) 23.6 11.3
【解析】试题分析:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解;(2)根据碳酸钠溶液中钠元素、碳元素的比为2:1写物料守恒式;(3)![]() =
=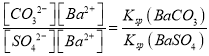 ;(4)Mg2+完全沉淀时,c(Mg2+)=1.0×105,根据Ksp[Mg(OH)2]=4.0×1011计算 OH-的浓度。
;(4)Mg2+完全沉淀时,c(Mg2+)=1.0×105,根据Ksp[Mg(OH)2]=4.0×1011计算 OH-的浓度。
解析:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解,CO32-+H2OHCO3-+OH-,所以溶液呈碱性;(2)碳酸钠溶液中钠元素、碳元素的比为2:1,含有碳元素的微粒有CO32-、HCO3-、H2CO3,碳酸钠溶液的物料守恒式c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);(3)![]() =
= =
=![]() ;(4)Mg2+完全沉淀时,c(Mg2+)=1.0×105,根据Ksp[Mg(OH)2]=4.0×1011, c(OH-)=
;(4)Mg2+完全沉淀时,c(Mg2+)=1.0×105,根据Ksp[Mg(OH)2]=4.0×1011, c(OH-)= ![]() ,c(H+)=
,c(H+)=![]() ,pH=
,pH=![]() 11.3。
11.3。

 口算能手系列答案
口算能手系列答案

