题目内容
【题目】I.铬单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子轨道表示式为________________;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于_________________。
(2)配合物CrCl3·6H2O的配位数为6,它有三种不同组成、不同颜色的固体,其中一种为浅绿色固体,该固体与足量硝酸银溶液反应时,0.5mol固体可生成1mol氯化银沉淀,则这种浅绿色固体的配体个数比(Cl-:H2O)为_____________。
II.砷化镓为第三代半导体材料,晶胞结构如图所示:

(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为__________。
(4)AsH3分子的立体构型为__________,其中As原子的杂化方式是______。1个(CH3)3Ga分子中含有_________个σ键,砷的第一电离能_______(填“>”或“<”)镓的第一电离能。
(5)砷化镓晶休中砷和镓的最近原子核间距为a nm,砷化镓的摩尔质量为bg·mol-1,阿伏加德罗常数值为NA,则砷化镓晶体的密度表达式是_____________g·cm-3。
【答案】 ![]() 分子晶体 1:5 (CH3)2Ga+AsH3
分子晶体 1:5 (CH3)2Ga+AsH3![]() 3CH4+GaAs 三角锥形 sp3 12 >
3CH4+GaAs 三角锥形 sp3 12 > ![]()
【解析】试题分析:(1)Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其3d、4s电子为其价电子;根据相似相容原理分析;(2)浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,说明三个Cl-中只有一个作配位体,由于其配位数为6,所以还有5个水作配位体。Ⅱ.(3)根据元素守恒得方程式: (CH3)3Ga+AsH3![]() 3CH4+GaAs。(4)镓的价电子对数为(5+3)÷2=4,镓原子的杂化方式是sp3杂化,镓原子有1个孤对电子。共价单键为σ键;同周期元素第一电离能从左到右增大;(5)在砷化镓晶胞中,含有Ga:8×1/8+6×1/2=4,含有As:4个,因此每个晶胞中含有4个GaAs。在砷化镓晶体中最近的砷和镓原子核间距为a cm,由于As处于与它相连的四个Ga构成的四面体的几何中心。距离最近且相等的As原子之间的距离为L.则
3CH4+GaAs。(4)镓的价电子对数为(5+3)÷2=4,镓原子的杂化方式是sp3杂化,镓原子有1个孤对电子。共价单键为σ键;同周期元素第一电离能从左到右增大;(5)在砷化镓晶胞中,含有Ga:8×1/8+6×1/2=4,含有As:4个,因此每个晶胞中含有4个GaAs。在砷化镓晶体中最近的砷和镓原子核间距为a cm,由于As处于与它相连的四个Ga构成的四面体的几何中心。距离最近且相等的As原子之间的距离为L.则![]() ;
;![]() .最近的两个As在晶胞面对角线的1/2处。设该晶胞的长度是x cm ,则
.最近的两个As在晶胞面对角线的1/2处。设该晶胞的长度是x cm ,则![]() ;解得x=
;解得x= ![]() 是则砷化镓晶体密度的表达式为:
是则砷化镓晶体密度的表达式为:![]() .整理可得
.整理可得![]()
解析:(1)基态铬原子的价电子轨道表示式为Cr原子核外电子数为24,其3d、4s电子为其价电子,基态铬原子的价电子轨道表示式为![]() ; CCl4为非极性分子溶剂,根据相似相容原理可知CrO2Cl2的晶体类型是分子晶体;(2)浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,说明三个Cl-中只有一个作配位体,由于其配位数为6,所以还有5个水作配位体,则这种浅绿色固体的配体个数比(Cl-:H2O)为1:5;Ⅱ.(3)根据元素守恒得方程式: (CH3)3Ga+AsH3
; CCl4为非极性分子溶剂,根据相似相容原理可知CrO2Cl2的晶体类型是分子晶体;(2)浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,说明三个Cl-中只有一个作配位体,由于其配位数为6,所以还有5个水作配位体,则这种浅绿色固体的配体个数比(Cl-:H2O)为1:5;Ⅱ.(3)根据元素守恒得方程式: (CH3)3Ga+AsH3![]() 3CH4+GaAs。(4) AsH3中镓的价电子对数为(5+3)÷2=4,镓原子的杂化方式是sp3杂化,镓原子有1个孤对电子,所以AsH3的空间构型为三角锥形。共价单键为σ键,1个(CH3)3Ga分子中含有12个σ键,同周期元素第一电离能从左到右增大,砷的第一电离能>镓的第一电离能。(5)根据以上分析,设该晶胞的长度是x cm ,则
3CH4+GaAs。(4) AsH3中镓的价电子对数为(5+3)÷2=4,镓原子的杂化方式是sp3杂化,镓原子有1个孤对电子,所以AsH3的空间构型为三角锥形。共价单键为σ键,1个(CH3)3Ga分子中含有12个σ键,同周期元素第一电离能从左到右增大,砷的第一电离能>镓的第一电离能。(5)根据以上分析,设该晶胞的长度是x cm ,则![]() ;解得x=
;解得x= ![]() 是则砷化镓晶体密度的表达式为:
是则砷化镓晶体密度的表达式为:![]() .整理可得
.整理可得![]()

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。
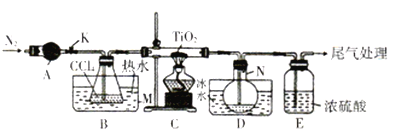
已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
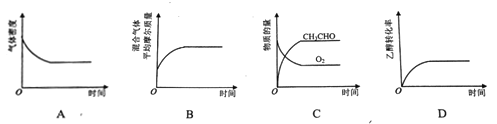
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5, ![]() ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
