题目内容
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:Ⅰ、SO2+2H2O+I2═H2SO4+2HI
Ⅱ、2HI?H2+I2
Ⅲ、2H2SO4═2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1mol O2的同时产生1mol H2
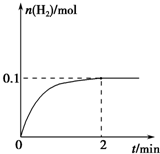
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(l)△H=-572kJ?mol-1某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)a.硫酸常温下,不易分解.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,化学方程式改变方向,平衡常数互为倒数;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)实验室用Zn和稀硫酸制取H2,随反应进行氢离子浓度减小,反应时溶液中水的电离平衡正向进行;依据影响化学反应速率因素分析判断增大反应速率的试剂,注意原电池反应的分析判断;
(4)先根据热化学方程式式求出生成1mol液态水,理论上放出的能量,然后根据电池的能量转化率=
×100%.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,化学方程式改变方向,平衡常数互为倒数;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)实验室用Zn和稀硫酸制取H2,随反应进行氢离子浓度减小,反应时溶液中水的电离平衡正向进行;依据影响化学反应速率因素分析判断增大反应速率的试剂,注意原电池反应的分析判断;
(4)先根据热化学方程式式求出生成1mol液态水,理论上放出的能量,然后根据电池的能量转化率=
| 实际生成量 |
| 理论生成量 |
解答:
解:(1)a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.1mol/L,用氢气表示的化学反应速率为
=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
=
=
,则该温度下,H2(g)+I2(g)?2HI(g)的平衡常数K=64;
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.1mol?L-1?min-1;64;b;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;;b;
(4)生成1mol液态水,理论上放出的能量为
=286KJ,电池的能量转化率=
×100%=
×100%=80%,故答案为:80%.
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
| c(H2)c(I2) |
| c2(HI) |
| 0.1×0.1 |
| 0.82 |
| 1 |
| 64 |
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.1mol?L-1?min-1;64;b;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;;b;
(4)生成1mol液态水,理论上放出的能量为
| 572KJ |
| 2 |
| 实际生成量 |
| 理论生成量 |
| 228.8KJ |
| 286KJ |
点评:本题主要考查了反应方程式的分析及计算,反应平衡图象,平衡常数、反应速率概念计算应用,难度中等.对于图象,要看清图象的含义、拐点、平衡点,结合平衡移动规律进行判断.

练习册系列答案
相关题目
砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
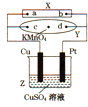 如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是( )
如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是( )| A、c电极的电极反应式为:2H++2e-=H2↑ |
| B、Cu电极质量减小,Pt电极质量增大 |
| C、Z中溶液的pH先减小,后增大 |
| D、a为电源正极,b为电源负极 |
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A、氧化铁、硫酸铜、硫酸 |
| B、氢氟酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |
化学与科学、技术、社会、环境密切相关.下列有关说法正确的是( )
| A、合金材料中可能含有非金属元素 |
| B、酒精有消毒杀菌作用,医用酒精浓度越大杀菌效果越好 |
| C、地沟油含有有害物质,不能进行加工制生物柴油 |
| D、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮的氧化物 |