题目内容
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
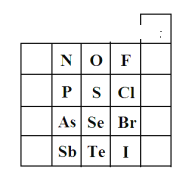
(1)N在元素周期表中的位置为第________周期第________族。根据元素周期律,预测酸性强弱:H3AsO4_______H3PO4(填“>”或“<”)。
(2)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度__________(填“更大”、“更小”或“相同”)。
(3)Br2具有较强的氧化性,将适量溴水加入KI-淀粉溶液中,出现的现象为____________________,发生的离子方程式为_________________________________;
【答案】二 ⅤA < 更小 溶液变蓝 Br2 +2I—=2Br—+I2
【解析】
(1)N元素原子有2个电子层,最外层电子数为5,位于元素周期表中第二周期第ⅤA族;同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3AsO4<H3PO4,故答案为:二;VA族;<。
(2)S和Se是同主族的元素,同主族元素性质具有相似性和递变性,按照O、S、Se的顺序单质和氢气反应的限度逐渐减小,故答案为:更小。
(3)Br2具有较强的氧化性,Br2的氧化性比I2,强将适量溴水加入KI-淀粉溶液中,Br2能将KI中的碘置换出来,生成单质碘,反应的离子方程式为:Br2 +2I—=2Br—+I2,单质碘遇到淀粉变为蓝色,故答案为:溶液变蓝,Br2 +2I—=2Br—+I2。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目