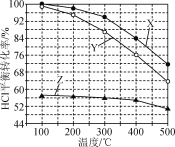
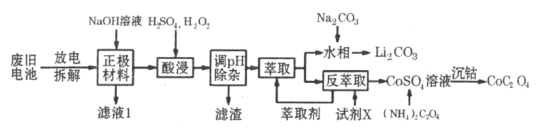
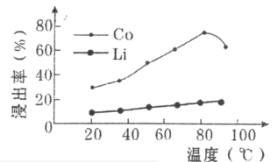
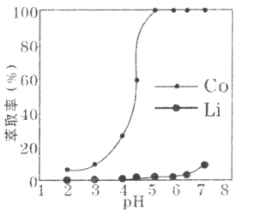
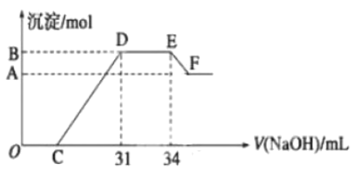
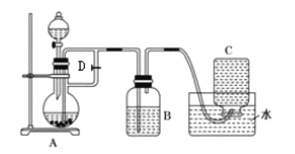
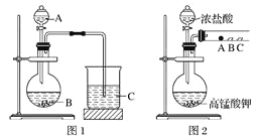
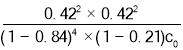题目内容
【题目】碱金属元素按原子序数增大,依次为:锂(![]() )、钠(
)、钠(![]() )、钾(
)、钾(![]() )、铷(
)、铷(![]() )、铯(
)、铯(![]() )、钫(
)、钫(![]() ,放射性元素)。请回答:
,放射性元素)。请回答:
(1) 钠钾合金许多特殊反应中有着非常重要的应用。取![]() 钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出
钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出![]() 纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
(2)将一定量的铝和过氧化钠混合物投入一盛有![]() 蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少
蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少![]() ,再向所得溶液中滴加
,再向所得溶液中滴加![]() 盐酸直至产生的沉淀刚好溶解,消耗盐酸
盐酸直至产生的沉淀刚好溶解,消耗盐酸![]() 。求原混合物中
。求原混合物中![]() 和
和![]() 各多少克?____、____
各多少克?____、____
(3)一定条件下,![]() 铷与氧气和臭氧的混合气体
铷与氧气和臭氧的混合气体![]() (已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物
(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物![]() 和
和![]() 的固体混合物。
的固体混合物。![]() 和
和![]() 中,阴阳离子个数比均为
中,阴阳离子个数比均为![]() 且均在两种微粒间作用力。已知
且均在两种微粒间作用力。已知![]() 的含氧量为0.3596。推断化合物
的含氧量为0.3596。推断化合物![]() 、
、![]() 的化学式分别为:____________、____________。
的化学式分别为:____________、____________。
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
(1)发生反应有:CCl4+4Na ![]() C(金刚石)+4NaCl、CCl4+4K
C(金刚石)+4NaCl、CCl4+4K ![]() C(金刚石)+4KCl,设出金属钠和钾的物质的量,然后分别根据合金总质量、生成金刚石的量列式计算;
C(金刚石)+4KCl,设出金属钠和钾的物质的量,然后分别根据合金总质量、生成金刚石的量列式计算;
(2)设生成氧气物质的量为x,生成氢气物质的量为y,结合化学方程式定量计算得到原混和物中Al和Na2O2的物质的量;
(3)根据含氧量计算出A的化学式,再结合铷与氧原子个数比,结合B中阴阳离子个数比均为![]() ,且均在两种微粒间作用力确定B的化学式。
,且均在两种微粒间作用力确定B的化学式。
(1)钠、钾与四氯化碳反应的方程式为:CCl4+4Na ![]() C(金刚石)+4NaCl、CCl4+4K
C(金刚石)+4NaCl、CCl4+4K ![]() C(金刚石)+4KCl,设合金中钠、钾的物质的量分别为x、y,则根据总质量可得:①23x+39y=59.80g,根据反应方程式可知,生成金刚石的总量为:②12×(x+y)×
C(金刚石)+4KCl,设合金中钠、钾的物质的量分别为x、y,则根据总质量可得:①23x+39y=59.80g,根据反应方程式可知,生成金刚石的总量为:②12×(x+y)×![]() =5.40g,联立①②解得:x=0.65、y=1.15,则合金中钠、钾的质量比为:(23g/mol×0.65mol)∶(39g/mol×1.15mol)=1∶3,故答案为:1∶3;
=5.40g,联立①②解得:x=0.65、y=1.15,则合金中钠、钾的质量比为:(23g/mol×0.65mol)∶(39g/mol×1.15mol)=1∶3,故答案为:1∶3;
(2)根据题意,所得溶液的质量比反应前上述三种物质总质量之和减少3.5g,是反应放出的氢气和氧气。设生成氧气物质的量为x,生成氢气物质的量为y,则有①x×32+y×2=3.5g
2Na2O2+2H2O=4NaOH+O2↑,
2 4 1
2x 4x x
2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
2 2 2 3
![]() y
y ![]() y
y![]() y y
y y
再向所得溶液中滴加3.5mol/L盐酸直至产生的沉淀刚好溶解,
NaAlO2+4HCl=AlCl3+2H2O+NaCl
1 1
![]() y
y ![]() y
y
最终溶液中的溶质为氯化钠和氯化铝,根据钠、铝和氯元素守恒有②4x+![]() y×3=0.2L×3.5mol/L,联立①和②解得:x=0.1mol,y=0.15mol,原混和物中,Al物质的量=0.15mol×
y×3=0.2L×3.5mol/L,联立①和②解得:x=0.1mol,y=0.15mol,原混和物中,Al物质的量=0.15mol×![]() =0.1mol,质量为2.7g,Na2O2物质的量=2×0.1mol=0.2mol,质量为0.2mol×78g/mol=15.6g,故答案为:2.7g;15.6g;
=0.1mol,质量为2.7g,Na2O2物质的量=2×0.1mol=0.2mol,质量为0.2mol×78g/mol=15.6g,故答案为:2.7g;15.6g;
(3)A中铷和氧的物质的量之比为:![]() ∶
∶![]() =1∶3,故A的化学式为:RbO3;标准状况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,混合气体对相同状况下氢气的相对密度为20.8,则混合气体的平均摩尔质量为41.6g/mol,因此含有氧原子的物质的量为
=1∶3,故A的化学式为:RbO3;标准状况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,混合气体对相同状况下氢气的相对密度为20.8,则混合气体的平均摩尔质量为41.6g/mol,因此含有氧原子的物质的量为![]() =2.6mol,85.5g铷的物质的量=
=2.6mol,85.5g铷的物质的量=![]() =1mol,设B的化学式为RbOy,因为B中阴阳离子个数比均为1∶1,故B中若含有1个B+离子,则含有一个阴离子,且均在两种微粒间作用力,因此阴离子中至少2个氧原子,又因为A为RbO3,则B中含有氧原子数少于2.6,只能为2,因此B的化学式为RbO2,故答案为:RbO3;RbO2。
=1mol,设B的化学式为RbOy,因为B中阴阳离子个数比均为1∶1,故B中若含有1个B+离子,则含有一个阴离子,且均在两种微粒间作用力,因此阴离子中至少2个氧原子,又因为A为RbO3,则B中含有氧原子数少于2.6,只能为2,因此B的化学式为RbO2,故答案为:RbO3;RbO2。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案