题目内容
5.下列关于化学与生产、生活的认识正确的是( )| A. | 实验室里熔化氢氧化钠时,可选用石英坩埚和铁坩埚 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等,PVC的单体可由PE的单体与氯化氢加成制得 | |
| D. | 家庭用食用醋代替CO2来增强漂白粉的漂白性 |
分析 A.石英坩埚与氢氧化钠反应;
B.“地沟油”是混合物,没有固定的熔沸点;
C.聚乙烯(PE)的单体是CH2═CH2、PVC的单体是CH2═CHCl;
D.醋酸的酸性大于次氯酸,因此醋酸可以和次氯酸钙反应可以生成次氯酸.
解答 解:A.石英坩埚与氢氧化钠反应,所以不能用石英坩埚熔化氢氧化钠,故A错误;
B.“地沟油”是混合物,没有固定的熔沸点,故B错误;
C.聚乙烯(PE)的单体是CH2═CH2,PVC单体为氯乙烯,应该由乙炔和HCl加成得到,故C错误;
D.漂白粉的有效成分为次氯酸钙,醋酸的酸性大于次氯酸,因此醋酸可以和次氯酸钙反应可以生成次氯酸,次氯酸具有强氧化性,可以做漂白剂,故D正确;
故选D.
点评 本题主要考查了元素及其化合物的化学性质,题目难度中等,熟练掌握有关物质的性质和化学反应方程式是解题的关键.

练习册系列答案
相关题目
15.下列有关Ca(ClO)2溶液的叙述正确的是( )
| A. | 该溶液中,K+、Cl-、HCOOH、I-可以大量共存 | |
| B. | 与Na2SO3反应的离子方程式:ClO-+SO32-═SO42-+Cl- | |
| C. | 不可使用pH试纸测定该溶液的pH | |
| D. | 1 L 0.1 mol/L该溶液和足量的CO2充分反应,产生10 g沉淀 |
16. 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
20.下列有关化学用语表示正确的是( )
| A. | 碳化钙(CaC2)的电子式:Ca2+[:C::C:]2- | |
| B. | ${\;}_{8}^{18}$O2-离子的结构示意图: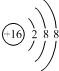 | |
| C. | 2-甲基-2-丙醇的结构简式: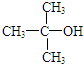 | |
| D. | Na2S水解的离子方程式:S2-+2H2O?2H2S+2OH- |

 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O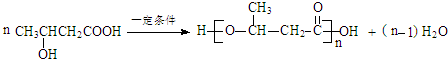 .
. .
.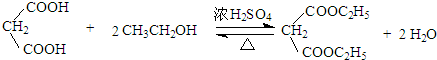 .
.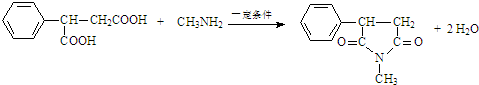 .
.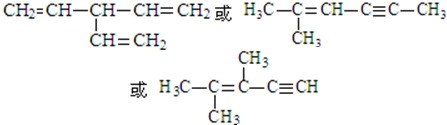 (写出一种即可).
(写出一种即可).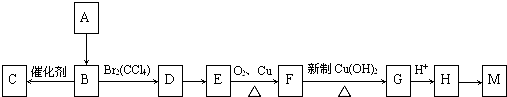
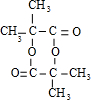 .
.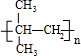 ;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
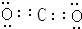 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).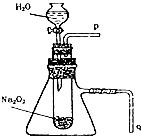 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.