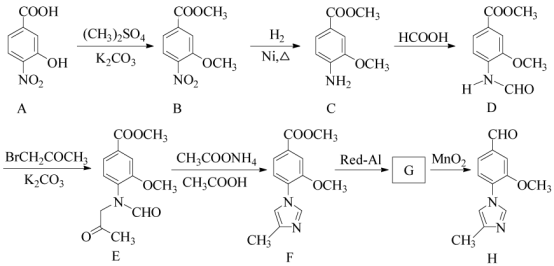
题目内容
【题目】[2017江苏]铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
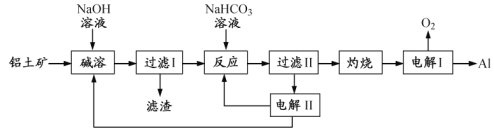
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
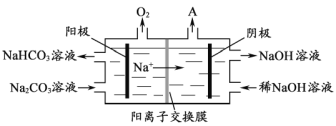
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
【答案】(1)Al2O3+2OH![]() 2
2![]() +H2O
+H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4![]() +2H2O4e
+2H2O4e![]() 4
4![]() +O2↑ H2
+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】结合流程及题中信息可知,铝土矿在碱溶时,其中的氧化铝和二氧化硅可与强碱溶液反应,过滤后,滤液中偏铝酸钠与碳酸氢钠反应生成氢氧化铝沉淀和碳酸钠,氢氧化铝经灼烧后分解为氧化铝,最后电解熔融的氧化铝得到铝。碳酸钠溶液经电解后可以再生成碳酸氢钠和氢氧化钠进行循环利用。
(1)氧化铝为两性氧化物,可溶于强碱溶液生成偏铝酸钠和水,离子方程式为Al2O3+2OH![]() 2
2![]() +H2O。
+H2O。
(2)为了提高铝土矿的浸取率,氢氧化钠溶液必须过量,所以过滤I所得滤液中含有氢氧化钠,加入碳酸氢钠溶液后,氢氧化钠与碳酸氢钠发生反应生成碳酸钠和水,所以溶液的pH减小。
(3)电解I过程中,石墨阳极上氧离子被氧化为氧气,在高温下,氧气与石墨发生反应生成气体,所以,石墨电极易消耗的原因是被阳极上产生的氧气氧化。
(4)由图中信息可知,生成氧气的为阳极室,溶液中水电离的OH放电生成氧气,破坏了水的电离平衡,碳酸根结合H+转化为![]() ,所以电极反应式为4
,所以电极反应式为4![]() +2H2O4e
+2H2O4e![]() 4
4![]() +O2↑,阴极室氢氧化钠溶液浓度变大,说明水电离的H+放电生成氢气而破坏水的电离平衡,所以阴极产生的物质A为H2。
+O2↑,阴极室氢氧化钠溶液浓度变大,说明水电离的H+放电生成氢气而破坏水的电离平衡,所以阴极产生的物质A为H2。
(5)铝在常温下就容易与空气中的氧气反应生成一层致密的氧化膜。氯化铵受热分解产生的氯化氢能够破坏铝表面的氧化铝薄膜,所以加入少量的氯化铵有利于AlN的制备。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:

资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
(1)B中所盛的试剂是________,干燥管的作用是_____________________。
(2)POC13遇水反应的化学方程式为____________________________。
(3)装置B的作用除干燥O2外,还有_____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是__________________________。
(6)步骤④中X为____________________ 。
(7)反应中POC13的百分含量为_________,通过__________(填操作)可以提高产品的纯度。