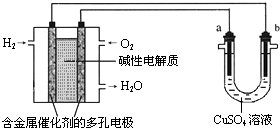
题目内容
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
【答案】
(1)![]() ;3;纺锤形
;3;纺锤形
(2)3;sp2
(3)3
(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B
(5)V形
(6)12;![]() ×1010
×1010
【解析】解:(1)Si为14号元素,价层电子排布图为 ![]() ,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是:
,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是: ![]() ;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
所以答案是:电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B;(5)NO2﹣中N价层电子对个数=2+ ![]() =3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
=3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
所以答案是:V形;(6)①根据图知,每个最小环上含有6个Si原子、6个O原子,所以晶胞中最小的环含有12个原子,所以答案是:12;
②金刚石晶胞中4个C原子在晶胞内部,6个C原子在面心上、8个C原子分别位于8个顶点上,所以该晶胞中C原子个数=4+8× ![]() +6×
+6× ![]() =8,该晶胞体积=
=8,该晶胞体积= ![]() cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的
cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的 ![]() =
= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]()
![]() cm=
cm= ![]()
![]() ×1010pm,
×1010pm,
所以答案是: ![]()
![]() ×1010 .
×1010 .

【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH ![]() +6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
+6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色.
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.101 0molL﹣1 , 则该样品中氮的质量分数为(保留4位有效数字)
【题目】Si3N4是一种重要的新型无机非金属材料,能被强碱腐蚀;实验室可利用SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅,实验装置示意图(加热和夹持装置略去)和有关性质如下: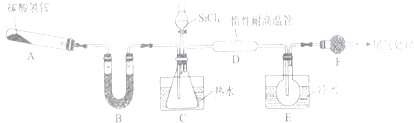
物质 | 熔点/℃ | 沸点/℃ | |
SiCl4 | ﹣70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
Si3N4 | 1900 | ﹣ | 性质稳定 |
请回答下列问题:
(1)装置B中所加入的试剂名称为 .
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为 .
(3)反应开始前先组装好仪器,(填操作步骤)后,再加装药品,接下来的操作是(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为 .
(5)反应过程中,装置E中的现象为 .
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000molL﹣1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500molL﹣1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为 .
②产品中Si3N4的质量分数为(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为 .