题目内容
9.常温下,已知0.1mol/L的CH3COOH和HCN溶液的pH分别为a、b,且1<a<b,下列有关叙述不正确的是( )| A. | CH3COOH与HCN均为弱酸 | |
| B. | 常温下,等浓度CH3COONa溶液的pH小于NaCN溶液的pH | |
| C. | 在CH3COONa溶液中,c(Na+)+c(H+)═c(CH3COO-)+c(CH3COOH) | |
| D. | 在NaCN溶液中,c(Na+)>c(CN-) |
分析 常温下,已知0.1mol/L的CH3COOH和HCN溶液的pH分别为a、b,且1<a<b,说明都是弱酸,而同浓度PH值越大,酸的电离程度越小,对应的酸越弱,结合物料守恒分析解答.
解答 解:A、因为常温下,已知0.1mol/L的CH3COOH和HCN溶液的pH分别为a、b,且1<a<b,所以两种酸都弱酸,故A正确;
B、酸越弱对应酸根离子水解能力越强,所以等浓度CH3COONa溶液的水解程度小于NaCN溶液的水解程度,所以pH(NaCN)>pH(CH3COONa),故B正确;
C、根据物料守恒,在CH3COONa溶液中,钠离子的浓度与醋酸离子所有存在形式的浓度相等,所以c(Na+)═c(CH3COO-)+c(CH3COOH),故C错误;
D、在NaCN溶液中,弱离子CN-水解,导致c(Na+)>c(CN-),故D正确;
故选C.
点评 本题考查了弱电解质的电离,明确弱电解质电离程度与弱酸根离子水解程度的关系即可解答,注意两种弱酸同浓度PH值越大,酸的电离程度越小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某化学小组合作研究Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
①Cl2与NaBr溶液、FeCl2溶液与溴水反应的离子方程式分别为2Br-+Cl2═Br2+2Cl-、2Fe2++Br2=2Fe3++2Br-.
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
①B中反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
②丙同学认为现象ⅱ中溶液变为棕黄色的原因是Cl2氧化Br-.丙同学设计实验进行验证,记录现象如下:
甲乙丙同学合作探究,证明了Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
| 试管 | 操作 | 现象 |
| a | 在试管中加入NaBr溶液,滴加少量氯水,用力振荡后,再加入少量CCl4,振荡静置 | CCl4层由无色逐渐变为橙红色 |
| b | ⅰ.在试管中加入FeCl2溶液,滴加两滴KSCN溶液 ⅱ.加入少量溴水,振荡 | ⅰ.浅绿色溶液无明显变化 ⅱ.溶液变为红色 |
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
| 操作 | A中现象 |
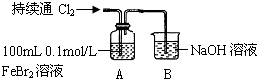 | ⅰ.开始通入100mL(折合标准状况)Cl2,溶液由浅绿色逐渐变黄 ⅱ.继续通入Cl2,溶液黄色加深,当变为棕黄色后,停止通入Cl2 |
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
| 试管 | 操作 | 现象 |
| c | 滴加2-3滴KSCN溶液,振荡 | 溶液变为血红色 |
| d | 加入少量CCl4,振荡,静置 | 出现分层现象,下层为四氯化碳,且呈无色 |
| 试管 | 操作 | 现象 |
| e | 在试管中加入2mL棕黄色溶液,加入少量CCl4,振荡,静置 | CCl4层由无色变为橙红色 |
17.下列各组物质的性质顺序,不正确的是( )
| A. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 原子半径:Na<Mg<Al | D. | 熔点:SiO2>NaCl>CO2 |
4.能证明硅酸的酸性比碳酸的酸性弱的实验事实是( )
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀 | |
| B. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | 氯化氢通入碳酸钠溶液中放出气体,通入硅酸钠溶液中生成沉淀 |
14.化学在生产和日常生活中有着重要的作用,下列叙述正确的是( )
| A. | 氧化铝的熔点很低,不能用于制作耐高温材料 | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 无水乙醇用作医用消毒剂效果更好 | |
| D. | Na、S、C分别在氧气中点燃均可得到两种不同的氧化物 |
1.下列生活常见现象中,没有涉及化学变化的是( )
| A. | 钢铁生锈 | B. | 海水晒盐 | C. | 食物腐败 | D. | 臭氧消毒 |
18.以下物质间的每一步转化通过一步反应能实现的是( )
①Al→Al2O3→Al(OH)3→NaAlO2
②Fe→FeCl2→Fe(OH)2→Fe(OH)3
③S→SO3→H2SO4→MgSO4
④N2→NO→NO2→HNO3.
①Al→Al2O3→Al(OH)3→NaAlO2
②Fe→FeCl2→Fe(OH)2→Fe(OH)3
③S→SO3→H2SO4→MgSO4
④N2→NO→NO2→HNO3.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6g铁与足量稀硫酸反应转移的电子数为0.3NA | |
| B. | 标准状况下,11.2L水中含有分子的数目为0.5NA | |
| C. | 500 mL 0.2 mol•L-1 CaCl2溶液中氯离子数目为 0.1NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
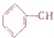 =CH2 D.
=CH2 D.