题目内容
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究。
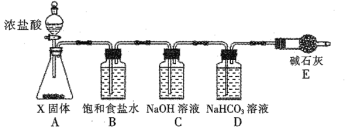
(1)X固体为_________(填化学式),装置E的名称是_________。
(2)氯气与NaOH溶液、NaHCO3溶液都会发生反应,生成物均含有+1价氯的物质,其化学式分别为____________________、___________。
(3)将反应后的装置C溶液,从pH=11调到pH=5的过程中,其溶液的漂白性逐渐_____,理由是_____________。
(4)装置C需要冰水浴,否则产率大大下降,原因是__________。
【答案】KMnO4 干燥管 NaClO HClO 增强 随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强 氯气与碱反应放热,使NaClO分解
【解析】
装置A中固体X和浓盐酸在常温下反应生成氯气,氯气中含氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通入装置C中与氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,可以除去反应剩余的氯气,最后通过碱石灰吸收尾气中氯气,防止污染环境,据此分析解答。
(1)装置A中固体X和浓盐酸在常温下反应生成氯气,可以选用高锰酸钾;根据图示,装置E为干燥管,故答案为:KMnO4;干燥管;
(2)氯气与NaOH溶液反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O;氯水中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大,在碳酸氢钠溶液中得到HClO,故答案为:NaClO;HClO;
(3)反应后的装置C溶液中含有NaClO,将溶液从pH=11调到pH=5的过程中,随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强,故答案为:增强;随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强;
(4)氯气与碱的反应为放热反应,升高温度会使次氯酸钠分解,因此装置C需要冰水浴,否则产率大大下降,故答案为:氯气与碱反应放热,使NaClO分解。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案