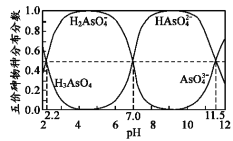
题目内容
【题目】实验室可用NaBr、浓硫酸、乙醇等为原料制备少量溴乙烷(反应装置如图所示):C2H5—OH+HBr![]() C2H5—Br+H2O
C2H5—Br+H2O
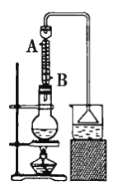
已知物质的用量:0.30molNaBr(s);0.25mol乙醇(密度为0.80g·cm-3);36mL浓硫酸(质量分数为98%,密度为1.84g·mL-1);25mL水。试回答下列问题:
(1)反应装置中烧瓶的容积应选择__(填序号)。
A.50mL B.100mL C.150mL D.250mL
(2)冷凝管中的冷凝水的流向应是__(填序号)。
A.A进B出 B.B进A出 C.从A进或B进均可
(3)实验完成后,需将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净的溴乙烷,应采取的操作是___。
(4)某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解反应还是消去反应,则该同学向反应后的溶液中应加入的试剂是__。
【答案】C B 将粗溴乙烷和稀![]() 溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷 稀盐酸、溴水
溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷 稀盐酸、溴水
【解析】
(1)烧瓶内所盛液体的体积不应超过其容积的三分之二,但也不能少于容积的四分之一,计算液体的体积和,便可确定所选烧瓶的规格。
(2)冷凝管中的冷凝水流向应是下进上出。
(3)溴乙烷中常会混有溴而使其显棕黄色,应加入碱溶液处理。
(4)水解反应主产物为乙醇,消去反应主产物为乙烯,选择能区分二者的试剂,便可确定发生反应的类型。
(1)乙醇的体积为![]() =14.4mL,浓硫酸的体积为36mL,水的体积为25mL,液体的总体积为75.3mL,按“烧瓶内所盛液体的体积不应超过其容积的三分之二”计算,烧瓶的容积为113mL,故选C。答案为C;
=14.4mL,浓硫酸的体积为36mL,水的体积为25mL,液体的总体积为75.3mL,按“烧瓶内所盛液体的体积不应超过其容积的三分之二”计算,烧瓶的容积为113mL,故选C。答案为C;
(2)为了使冷凝效果更佳,冷凝管中的冷凝水的流向应是下进上出,故选B。答案为B;
(3)除去溴乙烷中的溴,可使用NaOH溶液进行处理,具体操作是将粗溴乙烷和稀![]() 溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷。答案为:将粗溴乙烷和稀
溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷。答案为:将粗溴乙烷和稀![]() 溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷;
溶液的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷;
(4)某同学在溴乙烷中加入NaOH乙醇溶液并加热,判断发生的是水解反应还是消去反应,需检验产物是乙醇还是乙烯。为方便起见,可检验乙烯,从而确定用溴水,但同时需去除NaOH,以防与溴发生反应,所以应加入的试剂是稀盐酸、溴水。答案为:稀盐酸、溴水。

 天天向上口算本系列答案
天天向上口算本系列答案