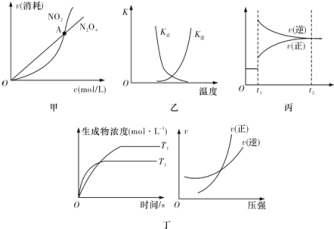
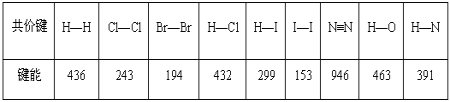
题目内容
【题目】现有下列8种物质:①Na2CO3 ②NaHCO3 ③NH4Cl ④酒精 ⑤CO2 ⑥Al ⑦食盐水 ⑧H2C2O4(草酸)
(1)上述物质中属于强电解质的是_________________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________________(填序号)。
(2)上述③的水溶液呈酸性的原因是(用离子方程式表示)_________________。
(3)请写出⑧使KMnO4酸性溶液褪色的离子方程式_____________。
【答案】①②③ ②⑥ NH4++H2O ![]() NH3·H2O+ H+ 2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O
NH3·H2O+ H+ 2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O
【解析】
①Na2CO3 ②NaHCO3 ③NH4Cl ④酒精 ⑤CO2 ⑥Al ⑦食盐水 ⑧H2C2O4(草酸)
(1)①Na2CO3是盐,属于强电解质,只能与盐酸反应;
②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;
③NH4Cl属于盐,是强电解质,能与NaOH反应,生成氨气;
④C2H5OH属于非电解质;
⑤CO2是非电解质,能与NaOH溶液反应生成碳酸钠或碳酸氢钠和水;
⑥Al是单质,不是电解质,也不是非电解质;但既能跟NaOH溶液反应,又能跟盐酸反应;
⑦食盐水属于混合物,不是电解质,也不是非电解质;
⑧H2C2O4是弱酸,属于弱电解质,能与NaOH发生中和反应;
故上述物质中属于强电解质的是①②③,既能跟盐酸反应又能跟NaOH溶液反应的是②⑥;
(2)NH4Cl的水溶液呈酸性的原因是NH4+的水解缘故,发生水解反应的离子方程式为NH4++H2O ![]() NH3·H2O+ H+;
NH3·H2O+ H+;
(3)H2C2O4有还原性,能使KMnO4酸性溶液褪色,氧化产物为CO2,发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
【题目】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有还原性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D