题目内容
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
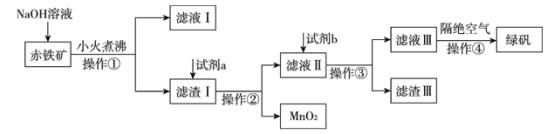
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
【答案】防止Fe2+被氧化2Fe2++Cl2=2Fe3++2Cl—隔绝空气(排除氧气对实验的影响)Al2O3+2OH-=2AlO2-+H2OSiO2+2OH-=SiO32-+H2O硫酸(H2SO4)Fe+2Fe3+=3Fe2+Fe+Cu2+=Cu+Fe2+Fe+2H+=H2↑+Fe2+过滤防止溶液中的Fe2+被空气氧化为Fe3+
【解析】
(一)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;氯气具有氧化性,能氧化氯化亚铁生成氯化铁;煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响。(二)赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等),由制备流程可知,加NaOH溶液后,两性氧化物Al2O3、酸性氧化物SiO2与NaOH溶液反应,则滤液I中含有的离子为OH-、AlO2-、SiO32-,滤渣I中含Fe2O3、FeO、MnO2、CuO;加入硫酸溶液,Fe2O3、FeO、CuO溶于硫酸,得到含有硫酸、Fe2(SO4)3、FeSO4、CuSO4的混合液,则试剂a为硫酸;向混合液中加入Fe,Fe与硫酸、Fe2(SO4)3、CuSO4反应得到FeSO4溶液,则试剂b为Fe,滤渣Ⅲ为Cu、Fe,滤液Ⅲ为FeSO4溶液,FeSO4溶液经蒸发浓缩、冷却结晶得到绿矾。
(一)(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响。(二)(1)赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等),由制备流程可知,加NaOH溶液后,两性氧化物Al2O3、酸性氧化物SiO2与NaOH溶液反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,,SiO2+2OH-=SiO32-+H2O。(2)试剂a为硫酸,Fe2O3、FeO、CuO溶于硫酸,得到含有硫酸、Fe2(SO4)3、FeSO4、CuSO4的混合液;试剂b为Fe,投入到滤液Ⅱ发生的所有反应的方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+
FeSO4、Fe+H2SO4=H2↑+FeSO4。(3)实验室中操作①②③均为固液分离,操作名称为过滤。(4)FeSO4溶液在空气中,易被空气中氧气氧化,隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。

【题目】
(1)根据计算用托盘天平需称取氯化钠_________ g;
(2)配制溶液时,除需要烧杯、玻璃棒外,还必须用到的玻璃仪器有 ;
(3)配制溶液有下列几步操作:a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容.正确的操作顺序是 ;
(4)下列操作结果使溶液物质的量浓度偏低的是___ ______ ;
A.没有将洗涤液转入容量瓶中 |
B.加水定容时,水的量超过了刻度线 |
C.定容时,俯视容量瓶的刻度线 |
D.容量瓶洗涤后,未经干燥处理 |
(5)取出该NaCl溶液10mL加水稀释到200mL,稀释后溶液中NaCl的物质的量浓度是_________



