��Ŀ����
����Ŀ��ijǿ������ҺX�н�����Ba2����Al3����NH4����Fe2����Fe3����CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������
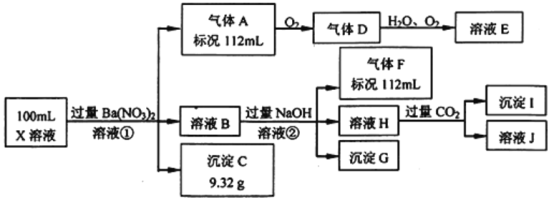
����������Ϣ���ش���������:
(1)��������������ʵ�鲻��ȷ����ҺX���Ƿ��е����ӷֱ���________��
(2)������������������Ũ��Ϊ2 mol/L��������10 mLʱ��ʼ����������55 mLʱ���������ﵽ���ֵ0.03 mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60 mLʱ����������Ϊ0.025 mol�ұ��ֲ��䣬��ԭ��Һ����c(Fe2+)Ϊ_____mol/L��c(Fe3+)Ϊ______mol/L��c(Cl-)Ϊ_____mol/L��(����Щ���Ӳ����ڣ�����0 mol/L)
���𰸡�Fe3+��Cl- 0.15 0.1 0.4
��������
(1)ǿ������Һ��һ���������CO32����SO32��������������ᱵ���ɳ�������ó���ΪBaSO4��˵����Һ�к���SO42������������A��A��������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���������������º�NO3����Ӧ����NO����ҺB�м������NaOH��Һ������GΪFe(OH)3����������F����FΪNH3��˵����Һ�к���NH4+����ҺH��ͨ��CO2���壬���ɳ���I����IΪAl(OH)3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+����Һ�к���Fe2+����һ������NO3��������SO42����һ������Ba2+������ȷ���Ƿ��е�Fe3+��Cl����
(2)���ݵ�ʧ��������Ⱥ��������ӵ�������������ͬ�����
(1)�ɷ�����֪����ȷ���Ƿ��е���Fe3+��Cl����
(2) n(NO)=![]() =0.005 mol�����ݵ�ʧ��������֪n(Fe2+)= n(NO)��3=0.015 mol��c(Fe2+)=0.015mol��0.1L=0.15mol/L����������������Һ60mLʱ����������0.025mol��˵����ʱΪ���������������������ӵ����ʵ�����0.015mol������˵��ԭ��Һ�д��������ӣ�n(Fe3+)=0.025mol��0.015mol=0.01mol����c(Fe3+)=0.01mol/0.1L=0.1mol/L������55mL����������Һʱ�����ﵽ���ֵ0.03mol������60mL����������Һʱ��������Ϊ0.025mol��˵��n(Al(OH)3)=0.03mol��0.025mol=0.005mol������Һ��SO42����0.04mol��NH4+��0.005mol��Fe2+��0.015mol��Fe3+��0.01mol��Al3+��0.005mol����ʱ2n(SO42��)=n(NH4+)+2n(Fe2+)+3n(Fe3+)+3n(Al3+)������c(Cl��)=0.4 mol/L��
=0.005 mol�����ݵ�ʧ��������֪n(Fe2+)= n(NO)��3=0.015 mol��c(Fe2+)=0.015mol��0.1L=0.15mol/L����������������Һ60mLʱ����������0.025mol��˵����ʱΪ���������������������ӵ����ʵ�����0.015mol������˵��ԭ��Һ�д��������ӣ�n(Fe3+)=0.025mol��0.015mol=0.01mol����c(Fe3+)=0.01mol/0.1L=0.1mol/L������55mL����������Һʱ�����ﵽ���ֵ0.03mol������60mL����������Һʱ��������Ϊ0.025mol��˵��n(Al(OH)3)=0.03mol��0.025mol=0.005mol������Һ��SO42����0.04mol��NH4+��0.005mol��Fe2+��0.015mol��Fe3+��0.01mol��Al3+��0.005mol����ʱ2n(SO42��)=n(NH4+)+2n(Fe2+)+3n(Fe3+)+3n(Al3+)������c(Cl��)=0.4 mol/L��

