题目内容
红热的铁与水蒸气可发生反应:3Fe+4H2O(g) Fe3O4+4H2.该反应中氧化剂是______(填化学式,下同),还原剂是______.若消耗了1.5mol Fe,则生成______mol H2.
Fe3O4+4H2.该反应中氧化剂是______(填化学式,下同),还原剂是______.若消耗了1.5mol Fe,则生成______mol H2.
【答案】分析:所含元素化合价降低反应物是氧化剂,所含元素化合价升高的反应物是还原剂,根据方程式计算耗了1.5mol Fe生成 H2的物质的量.
解答:解:反应3Fe+4H2O(g)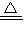 Fe3O4+4H2中,氢元素化合价由H2O中+1价降低为H2中0价,故H2O是氧化剂;铁元素化合价由Fe中的价升高为Fe3O4中+2、+3价,Fe是还原剂;
Fe3O4+4H2中,氢元素化合价由H2O中+1价降低为H2中0价,故H2O是氧化剂;铁元素化合价由Fe中的价升高为Fe3O4中+2、+3价,Fe是还原剂;
由方程式可知n(H2)= n(Fe)=
n(Fe)= ×1.5mol=2mol.
×1.5mol=2mol.
故答案为:H2O;Fe;2.
点评:本题考查氧化还原反应基本概念与根据方程式计算等,比较基础,掌握利用化合价判断氧化还原反应的基本概念.
解答:解:反应3Fe+4H2O(g)
 Fe3O4+4H2中,氢元素化合价由H2O中+1价降低为H2中0价,故H2O是氧化剂;铁元素化合价由Fe中的价升高为Fe3O4中+2、+3价,Fe是还原剂;
Fe3O4+4H2中,氢元素化合价由H2O中+1价降低为H2中0价,故H2O是氧化剂;铁元素化合价由Fe中的价升高为Fe3O4中+2、+3价,Fe是还原剂;由方程式可知n(H2)=
 n(Fe)=
n(Fe)= ×1.5mol=2mol.
×1.5mol=2mol.故答案为:H2O;Fe;2.
点评:本题考查氧化还原反应基本概念与根据方程式计算等,比较基础,掌握利用化合价判断氧化还原反应的基本概念.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
 Fe3O4+4H2.该反应中氧化剂是 .该反应中,若消耗了3mol Fe,则生成 mol H2.
Fe3O4+4H2.该反应中氧化剂是 .该反应中,若消耗了3mol Fe,则生成 mol H2.