题目内容
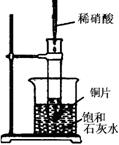
如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题:
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
Ⅰ.(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出固体(或烧杯中溶液变浑浊)
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2固体
(3)Mg+2H+=Mg2++H2↑ (4)小于 Ⅱ.放出 46
【解析】
试题分析:Ⅰ.(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高。由于氢氧化钙的溶解度随温度的升高而降低,所以溶液中析出固体溶质,溶液变浑浊。
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状。
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑。
(4)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片的盐酸的总能量。
Ⅱ. 反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据键能可知,该反应的反应热△H=436kJ/mol×3+946kJ/mol-2×3×391kJ/mol=-92kJ/mol,所以一定条件下由氢气和氮气反应生成1mol NH3需要放出的能量是92kJ/mol÷2×1.0mol=46kJ。
考点:考查化学反应中的能量变化、反应热的计算等
点评:该题是高考中的常见题型,属于中等难度的试题。试题在注重对学生基础知识巩固和训练的同时,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的灵活应变能力和规范答题能力。通过化学变化放热而使饱和溶液温度升高,此类本题之一巧;饱和溶液为溶解度随温度升高而减小的氢氧化钙的饱和溶液,此为本题又一巧;抓住二巧是解决问题的关键

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
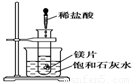
启东小题作业本系列答案 如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.
如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中. 如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)
如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)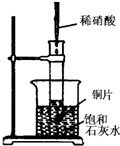 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题: