题目内容
元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A.XY2 | B.X2Y3 | C.X3Y2 | D.XY2 |
B
解析试题分析:元素X的原子核外M电子层上有3个电子则X的核外电子排布是2、8、3,是13号元素Al; 元素Y2-的离子核外有18个电子,则Y是16号元素S。原子的最外层电子数是该元素的最高化合价,而对于非金属元素来说,其最低负化合价与最高正化合价绝对值的和为8.在化合物中正负化合价的代数和为0.因此这两种元素形成的化合物为Al2S3.故选项为B。
考点:考查元素的原子结构与形成的化合物的化学式的确定的知识。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是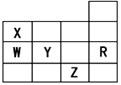
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是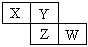
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是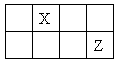
| A.原子半径: r(Y)> r (Z)> r (W) |
| B.Y、Z、W的简单离子的电子层结构相同 |
| C.XWm与YWn中化学键类型相同(m、n为正整数) |
| D.元素Z 的简单气态氢化物的热稳定性比W 的强 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的 |
元素R的最高价含氧酸分子式为HnRO2n -2 ,则在气态氢化物中,R元素的化合价为
| A.3n-12 | B.3n-6 | C.3n-4 | D.2n-4 |
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
| A.在电流的作用下,氖原子与构成灯管的物质发生反应 |
| B.电子由基态向激发态跃迁时吸收除红光以外的光线 |
| C.氖原子获得电子后转变成发出红光的物质 |
| D.电子由激发态向基态跃迁时以光的形式释放能量 |
下列叙述正确的是
| A.正戊烷与异戊烷互为同系物 |
| B.不同元素的原子形成的分子只含极性共价键 |
C.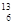 C和 C和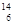 C是中子数不同质子数相同的同种核素 C是中子数不同质子数相同的同种核素 |
| D.短周期第IA与ⅦA族元素既可以形成离子化合物,也可以形成共价化合物 |