题目内容
在含有n mol FeBr2的溶液中,通入的Cl2的物质的量为x。
(1)当x≤0.5n mol时,这一反应的离子方程式是 。
(2)当x≥1.5n mol时,这一反应的离子方程式是 。
(3)当x=n mol时,这一反应的离子方程式是 。
(1)2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
(2)2Fe2++4Br-+3Cl2![]() 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
(3)2Fe2++2Br-+2Cl2![]() 2Fe3++Br2+4Cl-
2Fe3++Br2+4Cl-
解析:
Fe2+的还原性强于Br-的还原性,Cl2量少时应先氧化Fe2+,再氧化Br-。n mol FeBr2能电离出n mol Fe2+、2n mol Br-,依据得失电子守恒可知氧化n mol Fe2+需0.5n mol Cl2、氧化2n mol Br-需n mol Cl2。因此当x≤0.5n mol时,Cl2只氧化Fe2+;当x≥1.5n mol时,Fe2+与Br-全部被氧化,即参加反应的Fe2+与Br-的物质的量之比为1∶2;当x=n mol时,从得失电子守恒来看,氧化n mol Fe2+需0.5n mol Cl2、剩下0.5n mol Cl2能氧化n mol Br-,即参加反应的Fe2+与Br-的物质的量之比为1∶1。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
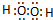




 (R、R'代表烃基或氢原子)
(R、R'代表烃基或氢原子)



 )的合成路线:
)的合成路线:

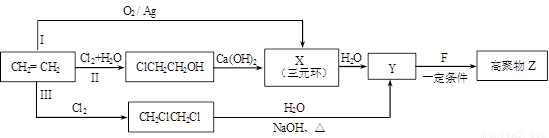
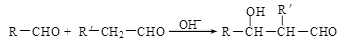 (R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。
(R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。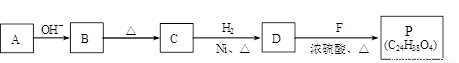

 (R、R,代表烃基或氢原子)。
(R、R,代表烃基或氢原子)。