题目内容
【题目】高纯铜![]() 广泛应用于电器工业,某粗铜样品中含Fe、Ni、Ag、Au等杂质,用电解法进行精炼.
广泛应用于电器工业,某粗铜样品中含Fe、Ni、Ag、Au等杂质,用电解法进行精炼.
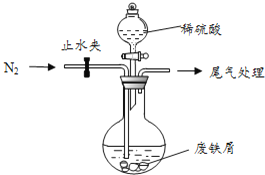
![]() 请在如图1电解装置图中标明电极材料和电解质溶液:_________
请在如图1电解装置图中标明电极材料和电解质溶液:_________
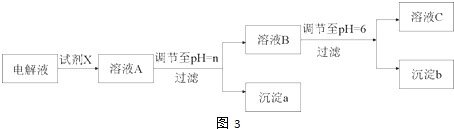
![]() 电解完毕后,某兴趣小组欲对电解液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线
电解完毕后,某兴趣小组欲对电解液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线![]() 如图
如图![]() .
.
![]() 结合图分析,相同温度下
结合图分析,相同温度下![]() 、
、![]() 、
、![]() 由大到小的顺序为 ______ .
由大到小的顺序为 ______ .
![]() 时溶液中铜元素的主要存在形式是: ______
时溶液中铜元素的主要存在形式是: ______ ![]() 写化学式
写化学式![]() .
.
![]() 若要除去
若要除去![]() 溶液中的少量
溶液中的少量![]() ,应该控制溶液的pH为 ______
,应该控制溶液的pH为 ______ ![]() 填字母
填字母![]() .
.
A.![]()
![]()
![]()
![]() 在
在![]() 溶液中含有少量的
溶液中含有少量的![]() 杂质, ______
杂质, ______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 通过调节溶液pH的方法来除去,理由是 ______ .
通过调节溶液pH的方法来除去,理由是 ______ .
![]() 乙同学设计了如图3操作步骤,顺利完成了溶液中的三种金属元素的分离.该方案中试剂X为 ______ ,
乙同学设计了如图3操作步骤,顺利完成了溶液中的三种金属元素的分离.该方案中试剂X为 ______ ,![]() ______ ,沉淀b的化学式为 ______ .
______ ,沉淀b的化学式为 ______ .
【答案】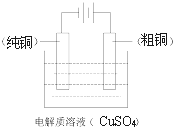
![]()
![]()
![]() 不能 因
不能 因![]() 和
和![]() 几乎有相同的
几乎有相同的![]() 图
图 ![]()
![]()
![]()
【解析】
![]() 电解精炼时,粗铜作阳极,纯铜作阴极,含有铜离子的溶液作电解质溶液;
电解精炼时,粗铜作阳极,纯铜作阴极,含有铜离子的溶液作电解质溶液;
![]() 根据形成沉淀时溶液中氢氧根离子的浓度即pH判断,pH越小,则
根据形成沉淀时溶液中氢氧根离子的浓度即pH判断,pH越小,则![]() 越小;
越小;
![]() 根据图象判断铜元素的主要存在形式;
根据图象判断铜元素的主要存在形式;
![]() 若要除去
若要除去![]() 溶液中的少量
溶液中的少量![]() ,应该把
,应该把![]() 转化为沉淀,而铜离子不能沉淀;
转化为沉淀,而铜离子不能沉淀;
![]() 当调节pH时,
当调节pH时,![]() 和
和![]() 都会转化为沉淀;
都会转化为沉淀;
![]() 先把
先把![]() 氧化为
氧化为![]() ,再调节pH除去,当
,再调节pH除去,当![]() 时,铜离子完全沉淀,
时,铜离子完全沉淀,![]() 和
和![]() 不沉淀。
不沉淀。
![]() 用电解精炼铜时,粗铜做阳极,阴极为精铜,可用可溶解性铜盐溶液,如硫酸铜等,电解装置图为:
用电解精炼铜时,粗铜做阳极,阴极为精铜,可用可溶解性铜盐溶液,如硫酸铜等,电解装置图为: ;故答案为:
;故答案为: ;
;
![]() 形成沉淀时溶液中氢氧根离子的浓度越小,即pH越小时,
形成沉淀时溶液中氢氧根离子的浓度越小,即pH越小时,![]() 越小,由图可知,相同温度下
越小,由图可知,相同温度下![]() 、
、![]() 、
、![]() 由大到小的顺序为:
由大到小的顺序为:![]() ;故答案为:
;故答案为:![]() ;
;
![]() 在
在![]() 左右很易溶解,显然
左右很易溶解,显然![]() 时溶液中铜元素的主要存在形式是
时溶液中铜元素的主要存在形式是![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由图可知
由图可知![]() 在
在![]() 左右沉淀完全,
左右沉淀完全,![]() 在
在![]() 左右很易溶解,要除去
左右很易溶解,要除去![]() 溶液中的少量
溶液中的少量![]() ,应控制溶液的pH在
,应控制溶液的pH在![]() 较合适,故选B;故答案为:B;
较合适,故选B;故答案为:B;
![]() 和
和![]() 几乎有相同的
几乎有相同的![]() 图,当调节PH时,二者会同时转化为沉淀,因此不能通过调节溶液pH的方法来除去
图,当调节PH时,二者会同时转化为沉淀,因此不能通过调节溶液pH的方法来除去![]() 溶液中含有少量的
溶液中含有少量的![]() 杂质;故答案为:因
杂质;故答案为:因![]() 和
和![]() 几乎有相同的
几乎有相同的![]() 图,因此不能通过调节溶液pH的方法来除去
图,因此不能通过调节溶液pH的方法来除去![]() 溶液中含有少量的
溶液中含有少量的![]() 杂质;
杂质;
![]() 为了不引入新杂质,先加入氧化剂把
为了不引入新杂质,先加入氧化剂把![]() 氧化成
氧化成![]() 时,可采用
时,可采用![]() 或
或![]() 等氧化剂;由氢氧化物的溶解度与pH关系图,
等氧化剂;由氢氧化物的溶解度与pH关系图,![]() 的合理范围时
的合理范围时![]() 转化为沉淀,而其他金属离子不沉淀;当
转化为沉淀,而其他金属离子不沉淀;当![]() 时,铜离子完全沉淀,
时,铜离子完全沉淀,![]() 和
和![]() 不沉淀,所以最后得到沉淀b的化学式为
不沉淀,所以最后得到沉淀b的化学式为![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;![]() 。
。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】根据要求,回答下列问题:
I.一定温度下,在容积为2L的恒容密闭容器中进行反应:aM(g)bN(g),M、N的物质的量随时间的变化曲线如下图所示:
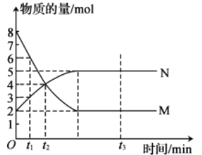
(1)此反应的化学方程式中,已知化学计量数之比为最简整数比,则b=________。
(2)若t2—t1=10min,则从t1到t2时刻,平均反应速率v(N)=________。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
II.一种新型催化剂用于 NO 和 CO 的反应:2NO+2CO2CO2 +N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验序号 | t(℃) | NO 初始浓度(mo1L-1) | CO初始浓度 (mo1L-1) | 催化剂的比表面积 (m2 g-1) |
I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
II | 280 | 1.20×10-3 | b | 124 |
III | 350 | a | 5.80×10-3 | 82 |
(1)表中,a=______,b=______。
(2)能验证温度对化学反应速率的影响规律的实验是________(填实验序号)。
(3)实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的曲线是___________(填“甲”或“乙”)。
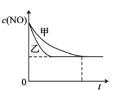
(4)若在容积固定的绝热容器中发生反应2NO+2CO2CO2 +N2,则不能说明该反应已达到平衡状态的是_________(填标号)。
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变 C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变