题目内容
【题目】常温时,向20 mL 0.1![]() 的 CH3CH2COOH 溶液中滴加0.1
的 CH3CH2COOH 溶液中滴加0.1![]() 的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
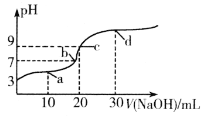
A. a 点溶液中 c(CH3CH2COO-) <c(Na+)
B. 图中四点,水的电离程度:c>d>b>a
C. c 点溶液中![]()
D. d 点溶液中c(Na+) +c(OH-) =c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH)
【答案】C
【解析】
从酸碱滴定曲线入手,分析加入不同体积NaOH溶液时溶质的成分,据溶液酸碱性判断弱电解质电离和盐类水解的主次,以及酸碱盐对水的电离平衡的影响等。
A项:a 点加入10mLNaOH溶液,充分反应后所得溶液中含溶质CH3CH2COOH、CH3CH2COONa各0.001mol。因pH<7,则溶液中CH3CH2COOH电离程度大于CH3CH2COO-水解程度,c(CH3CH2COO-) >c(Na+),A项错误;
B项:NaOH溶液加入前,CH3CH2COOH微弱电离出的H+抑制水电离;随着NaOH溶液的加入,CH3CH2COOH溶液浓度减小,这种抑制作用减弱,水的电离程度增大;恰好中和时,生成的CH3CH2COO-水解,使水的电离程度达到最大;之后加入的NaOH溶液过量,NaOH完全电离生成的OH-抑制水电离,水的电离程度又逐渐减小。故水的电离程度:c>b>a>d,B项错误;
C项:据图,加入NaOH溶液前,0.1![]() CH3CH2COOH溶液pH=3,则溶液中c(CH3CH2COO-)≈c(H+)=10-3
CH3CH2COOH溶液pH=3,则溶液中c(CH3CH2COO-)≈c(H+)=10-3![]() ,c(CH3CH2COOH)=0.1
,c(CH3CH2COOH)=0.1![]() -10-3
-10-3![]() ≈0.1
≈0.1![]() ,常温时CH3CH2COOH电离常数Ka=10-5,CH3CH2COO-水解常数Kh=Kw/Ka=10-9。c点加入20mLNaOH溶液,两者恰好完全反应得CH3CH2COONa溶液(pH=9),溶液中有水解平衡CH3CH2COO-+H2O
,常温时CH3CH2COOH电离常数Ka=10-5,CH3CH2COO-水解常数Kh=Kw/Ka=10-9。c点加入20mLNaOH溶液,两者恰好完全反应得CH3CH2COONa溶液(pH=9),溶液中有水解平衡CH3CH2COO-+H2O![]() CH3CH2COOH+OH-,将Kh=10-9、c(OH-)=10-5
CH3CH2COOH+OH-,将Kh=10-9、c(OH-)=10-5![]() 代入Kh表达式,得
代入Kh表达式,得![]() ,C项正确;
,C项正确;
D项:d 点加入30mLNaOH溶液,充分反应后所得溶液中含溶质为0.002molCH3CH2COONa、0.001molNaOH。电荷守恒c(Na+) +c(H+) = c(OH-)+c(CH3CH2COO-),物料守恒2c(Na+) =3c(CH3CH2COO-)+3c(CH3CH2COOH),两式相减得c(Na+) -c(H+) = 2c(CH3CH2COO-)+3c(CH3CH2COOH)-c(OH-),进而有c(Na+) +c(OH-) =c(H+) +2c(CH3CH2COO-) +3c(CH3CH2COOH)>c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH),D项错误。
本题选C。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】设反应①Fe(s) + CO2(g) ![]() FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g)
FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g)![]() FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)现有反应③ H2(g) + CO2(g) ![]() H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
(2)从上表和K1、K2和K3之间的关系可以推断:反应①是___________(填“吸”、“ 放”,下同)热反应,反应③是___________热反应。
(3)图表示该反应③在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
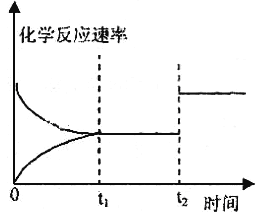
①图中时刻t2时改变的条件是_________(写出一种即可),
②973K时测得反应①中CO2和CO 的浓度分别为0.025mol/L和0.1mol/L,此时反应①是否处于化学平衡状态_______(选填“是”或“否”), 化学反应速度υ(正)_________υ(逆)(选填“>”、“<”或“=”)。
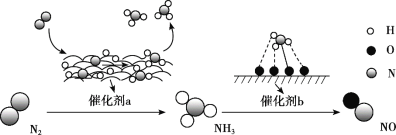
【题目】一维纳米材料因其特殊的纳米结构,呈现出一系列独特的光、电、磁、催化等性能,具有十分广阔的应用前景。ZnS-C(ZnS纳米粒子分散在碳纳米材料上)是新型一维纳米材料,某科研小组用下列流程制备ZnS-C纳米材料。
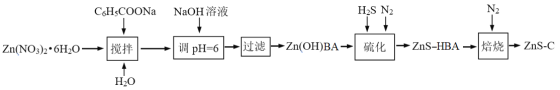
已知:BA表示C6H5COO
回答下列问题:
(1)“搅拌”后所得溶液显__________(填“酸性”“中性”或“碱性”)。
(2)配制NaOH溶液时,蒸馏水要煮沸的原因是____________。
(3)向混合盐溶液中缓缓滴加NaOH溶液,促进相关离子的水解,出现Zn(OH)(C6H5COO)白色沉淀。
①写出生成沉淀的离子方程式_________。
②25℃,调pH=6,不产生Zn(OH)2沉淀,该溶液中c(Zn2+)<____ mol·L-1。[已知Ksp[Zn(OH)2]=1.2×10-17]
(4)“硫化”、“焙烧”过程,Zn(OH)BA通过原位固相反应制备ZnS-C纳米纤维的过程示意图如下:
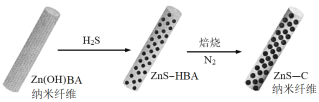
①该过程中一直处于原位的离子是____________;
②在N2氛围中“焙烧”时,HBA(C6H5COOH)分解的化学方程式为___________。
(5)用N2吸附法对不同焙烧温度下制备得到的ZnS-C纳米纤维的比表面积进行测定,在不同温度(400℃-800℃)下焙烧所得ZnS-C纳米纤维的比表面积如下表:
t/℃ | 400 | 500 | 600 | 700 | 800 |
比表面积/m2 ·g-1 | 130.1 | 123.1 | 70.2 | 49.2 | 47.6 |
① 随着温度的升高,ZnS纳米粒子__________(填“变大”“不变”或“变小”)。
② ZnS-C纳米纤维可将N2吸附在其表面,形成均匀的单分子层。氮气分子横截面积为0.162 nm2,则在400℃焙烧所得的1g ZnS-C纳米纤维最大吸附的氮分子数为______(保留3位有效数字)。