题目内容
18.为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内.| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaOH溶液 C.CaO | a.过滤 b.蒸馏 c.分液 | ① | ||
| ②乙醇(水) | ② | ||||
| ③乙酸乙酯(乙酸) | ③ | ||||
分析 ①苯酚与NaOH反应后,与苯分层;
②水与CaO反应后,增大与乙醇的沸点差异;
③乙酸与碳酸钠反应后,与乙酸乙酯分层.
解答 解:①苯酚与NaOH反应后,与苯分层,然后分液可除杂;
②水与CaO反应后,增大与乙醇的沸点差异,然后蒸馏可除杂;
③乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可除杂,
故答案为:
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaOH溶液 C.CaO | a.过滤 b.蒸馏 c.分液 | ① | B | c |
| ②乙醇(水) | ② | C | b | ||
| ③乙酸乙酯(乙酸) | ③ | A | c | ||
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法等为解答的关键,注意有机物的性质,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
8.关于下列实验装置及用途的叙述不正确的是( )
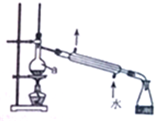

| A. | 仪器a为圆底烧瓶 | B. | 可用于实验室蒸馏石油 | ||
| C. | 可用于分离苯和溴苯的混合物 | D. | 可用于分离乙酸和乙醇的混合物 |
9.从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是:①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性( )
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
6.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
( )
( )
| A. | v(D)=0.40mol•L-1•s-1 | B. | v(C)=0.50mol•L-1•s_1 | ||
| C. | v(A)=0.30mol•L-1•s-1 | D. | v(B)=0.60mol•L-1•s-1 |
13.某单烯烃与H2加成后的产物是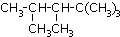 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
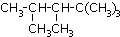 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
3.某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有( )
| A. | 2种 | B. | 1种 | C. | 4种 | D. | 5种 |
10.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 7.8gNa2O2固体中含有的离子数为4NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
8.一定温度下,向a L密闭容器中加入2mol NO2(g),发生反应:2NO2?2NO+O2,此反应达到平衡状态时的标志是( )
| A. | 混合气体的颜色变浅 | |
| B. | 混合气体的密度不再变化 | |
| C. | 混合气体中NO2、NO、O2物质的量之比为2:2:1 | |
| D. | 单位时间内生成2n mol NO,同时生成2n mol NO2 |
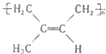 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种; .
.