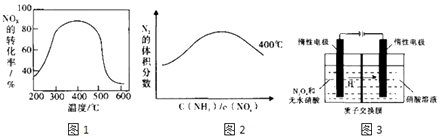
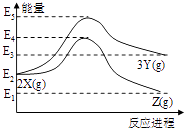
题目内容
【题目】Cu﹣C/FeCl3原电池中负极是 负极反应式:正极反应式: .
【答案】Cu;Cu﹣2e﹣=Cu2+;Fe3++e﹣=Fe2+
【解析】该原电池反应式为Cu+2FeCl3=2FeCl2+CuCl2 , Cu易失电子作负极,C作正极,负极上Cu失电子生成铜离子进入溶液,电极反应式为Cu﹣2e﹣=Cu2+ , 正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e﹣=Fe2+ , 所以答案为:Cu;Cu﹣2e﹣=Cu2+;Fe3++e﹣=Fe2+ .

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目