题目内容
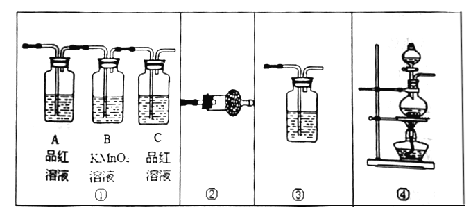
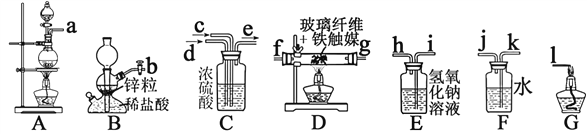
【题目】某小组同学用下图所示装置制取氨气并验证氨气的性质。
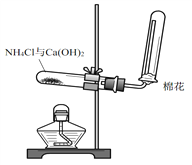
请回答:
(1)制取氨气的化学方程式是 ___________________________________。
(2)收集氨气的方法是_____________________(填“向上排空气法”或“向下排空气法”)。
(3)将湿润的红色石蕊试纸靠近集满氨气的试管口,试纸变蓝,说明氨气溶于水呈 _______________(填“酸”或“碱性”)。
(4)实验中加入5.35g的NH4Cl和足量的Ca(OH)2,充分反应,理论上收集到氨气的体积为 ____________________ L(标准状况)。
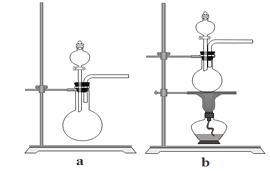
(5)已知生石灰遇水生成Ca(OH)2且放出大量的热,实验室也可以利用往生石灰中滴入浓氨水,快速制氨气。利用此方法制氨气选用的气体发生装置是 _________(填“a”或“b”)。
【答案】 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3![]() + 2H2O 向下排空气法 碱 2.24 a
+ 2H2O 向下排空气法 碱 2.24 a
【解析】试题分析:(1)实验室用加热氯化铵和氢氧化钙的方法制取氨气。
(2)氨气易溶于水,密度比空气小。
(3)碱能使石蕊试纸变蓝。
(4)根据化学方程式计算氨气的体积。
(5)根据固体与液体不需加热制取气体选择装置。
解析:(1)实验室用加热氯化铵和氢氧化钙的方法制取氨气,方程式为2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3
CaCl2 + 2NH3![]() + 2H2O 。
+ 2H2O 。
(2)氨气易溶于水,密度比空气小所以用向下排空气法收集氨气。
(3)碱能使石蕊试纸变蓝,将湿润的红色石蕊试纸靠近集满氨气的试管口,试纸变蓝,说明氨气溶于水呈碱性。 (4)设生成氨气的体积为vL
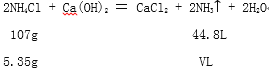
![]() ,v=2.24L。
,v=2.24L。
(5)往生石灰中滴入浓氨水,快速制氨气,属于固体与液体不需加热制取气体,选择装置a。

 小学课时特训系列答案
小学课时特训系列答案【题目】下表是元素周期表的一部分,表中的每个编号代表一种元素。请根据要求回答问题:
| ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)①的原子序数是____________________;
(2)②、⑤两种元素形成的简单气态氢化物,较稳定的是________________(化学式);
(3)③、④两种元素相比较,原子半径较大的是_________(填元素符号);
(4)写出①与⑥两种元素所形成化合物的电子式_____________。